【题目】黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水,不参与反应):
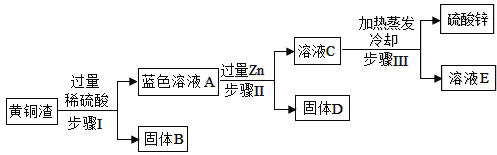
(1)步骤Ⅰ中产生气体的化学反应方程式为_____,属于_____反应(填写基本类型)。
(2)溶液A中的金属阳离子有_____(填化学式)。
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为_____,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是_____。
(4)溶液A的质量_____(填“大于”、“小于”或“等于”)溶液C的质量。原因是_____。
【答案】Zn+H2SO4![]() ZnSO4+H2↑ 置换 Zn2+、Cu2+ 过滤 玻璃棒 小于 65份质量的锌能置换出64份质量的铜,溶液的质量增加
ZnSO4+H2↑ 置换 Zn2+、Cu2+ 过滤 玻璃棒 小于 65份质量的锌能置换出64份质量的铜,溶液的质量增加
【解析】
(1)氧化锌和氧化铜分别与稀硫酸反应生成硫酸锌、硫酸铜和水,没有气体产生;而锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4![]() ZnSO4+H2↑,该反应为置换反应。(2)锌与稀硫酸反应生成硫酸锌和氢气,氧化锌与硫酸反应生成硫酸锌和水,氧化铜与硫酸反应生成硫酸铜和水,其中的金属阳离子是锌离子和铜离子。(3)由图可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜;过滤和蒸发操作中均用到玻璃棒这种玻璃仪器。(4)A到C的过程中发生的反应是Zn+CuSO4
ZnSO4+H2↑,该反应为置换反应。(2)锌与稀硫酸反应生成硫酸锌和氢气,氧化锌与硫酸反应生成硫酸锌和水,氧化铜与硫酸反应生成硫酸铜和水,其中的金属阳离子是锌离子和铜离子。(3)由图可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜;过滤和蒸发操作中均用到玻璃棒这种玻璃仪器。(4)A到C的过程中发生的反应是Zn+CuSO4![]() Cu+ZnSO4,由此可见,65份质量的锌置换出64份质量的铜,根据质量守恒定律,生成的硫酸锌的质量大于原溶质的质量,则溶液的质量增加。
Cu+ZnSO4,由此可见,65份质量的锌置换出64份质量的铜,根据质量守恒定律,生成的硫酸锌的质量大于原溶质的质量,则溶液的质量增加。

