【题目】小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验。
(1)量筒量取_______mL 98%浓硫酸(密度为1.84g/mL)配成100g 19.6%的稀硫酸。
(2)将上述配成的稀硫酸全部加入盛有10g合金样品的烧杯中,反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示。
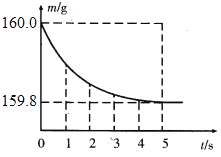
①产生氢气质量为______g。
②该合金样品中铜的质量分数为_______。
③反应后所得溶液中硫酸锌的质量分数。(写出解答过程,精确到0.1%)
参考答案:
【答案】(1)10.9ml(2)0.2g 35% 6.1%
【解析】
试题分析:(1)溶液稀释的构成中溶质的质量不变。设需要浓硫酸的质量为x;
98%x =100g×19.6% ,x=20g ;
浓硫酸的体积=20g÷1.84g/mL=10.9ml
(2)根据质量守恒定律化学反应前后物质的总质量不变。故减少的质量即为生成的氢气的质量。
由图可知,生成氢气的质量=160g-159.8g=0.2g ;
利用化学方程式,根据反应的质量比即可计算出合金中锌的质量。
设锌的质量为x ,所得溶液中硫酸锌的质量为y;
Zn+H2SO4==ZnSO4+H2↑
65 161 2
X y 0.2g
65/2=x/0.2g x=6.5g
合金中铜的质量=10g-6.5g=3.5g
该合金样品中铜的质量分数=3.5g/10g ×100% =35% ;
161/2=y/0.2g x=16.1g
反应后所得溶液的质量=6.5g+100g-0.2g=106.3g
溶液中硫酸锌的质量分数=6.5g/106.3g ×100% =6.1%
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年甘肃省兰州市】下列广告词对应商品的主要成分及类别错误的是( )
选项
广告词
商品
主要成分
类别
A
“衡水老白干,喝出男人味”
白酒
乙醇
有机物
B
“红梅味精,领先(鲜)一步”
味精
蛋白质
混合物
C
“吃了盖中盖,腰不酸了,腿不疼了,走路也有劲了”
补钙剂
碳酸钙
盐
D
“农夫山泉有点甜”
矿泉水
水
化合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年内蒙古呼和浩特市】在①合金、黄铁矿、石油、纯碱;②N2、P、Mg、O3;③Al2O3、Fe3O4、CuO、SO3。三组物质中,每组有一种物质在分类上与其他物质不同,这三种物质分别是( )
A.纯碱、Mg、SO3 B.黄铁矿、Mg、Al2O3
C.合金、O3、Fe3O4 D.纯碱、P、SO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述Ⅰ和叙述Ⅱ均正确,并且有因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
Na2CO3溶液呈碱性
Na2CO3属于碱
B
铁可以和稀H2SO4反应放出H2
Fe属于金属
C
金属Al是热的良导体
金属Al可以用来制作生活炊具
D
洗涤剂增大了油污在水中的溶解性
洗涤剂能除去衣服上的油污
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是
A.烧杯作为反应容器时不能直接加热
B.剩余的药品放回原试剂瓶中,不能随意丢弃
C.配制一定浓度的溶液,量取水时俯视量筒刻度会使溶液浓度偏低
D.用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象能正确反应其对应实验操作的是
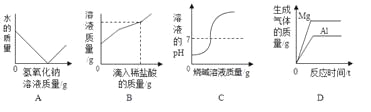
A. 向一定量的硫酸溶液中,滴加过量的氢氧化钠溶液
B. 向一定量的部分变质的氢氧化钠溶液中,滴加过量稀盐酸
C. 向一定量的稀硫酸中不断加烧碱溶液
D. 将等质量的镁粉和铝粉分别与足量等浓度的稀盐酸反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】按如图所示装置进行实验(图中铁架台等仪器均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是

A.甲:NaHCO3、稀HCl 乙:NaOH
B.甲:Al、稀H2SO4 乙:Ba(NO3)2溶液
C.甲:MgO、稀盐酸 乙:AgNO3
D.甲:Cu、稀H2SO4 乙:BaCl2溶液
相关试题

