【题目】化学实验和化学计算都是化学学习的重要内容。
(一)通过学习,我们已经掌握了一些气体的制备方法,如制取氧气的方法有:
甲.分离液体空气; 乙.加热分解高锰酸钾; 丙.分解过氧化氢; 丁.加热分解氯酸钾等;
也初步认识了一些气体的制取和收集装置,例如:
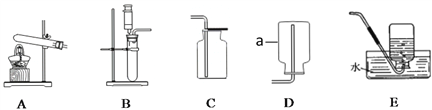
(1)仪器a 的名称是_____________。
(2)以上制取氧气的方法中,属于物理方法的是_______;要用到催化剂的反应有_________。
(3)若用方法丙制取氧气,应选用的装置组合为_____________(填字母序号),仿照23题示例写出该化学反应的表达式:___________________________________ 。
(4)某同学选择上述中的一种方法和仪器制取氧气,步骤如下:①加热药品;②装药品并将试管固定在铁架台上;③检查装置的气密性;④当连续冒气泡时,用排水法收集气体后取出正放在桌面上;⑤移去酒精灯;⑥把导管从水槽中取出。
正确的操作顺序用序号表示为:___________________________;如果步骤⑤⑥顺序错误,可能引起的后果是____________________________________________。
(二)亚硝酸氮[ N(NO2)3 ]是一种新型火箭燃料。
(1)每个亚硝酸氮分子中所含的原子个数为___________。
(2)亚硝酸氮分子中氧元素与氮元素的质量最简单整数比为___________。
(3)列式计算亚硝酸氮中氧元素的质量分数_______________(结果保留一位小数)。
参考答案:
【答案】 集气瓶 甲 丙、丁 B、C(或B、E) H2O2 ![]() H2O+ O2 ③②①④⑥⑤ 水槽中的水倒流至试管使试管炸裂 10 12:7
H2O+ O2 ③②①④⑥⑤ 水槽中的水倒流至试管使试管炸裂 10 12:7 ![]()
【解析】【试题分析】
本题重点考查的是氧气的制取和有关化学式的相关计算。(一)氧气的制取分为工业制法和实验室制法,(1)收集氧气所用的装置a为集气瓶;(2)工业上利用分离液态空气法制取氧气,是利用液氮和液氧的沸点不同将氮气和氧气分离开来,在分离过程中没有新物质的生成,是物理变化;在实验室制取氧气时,丙、丁两种方法制取氧气反应速率较慢,需要加入催化剂,加快反应的速率;(3)选择反应装置的依据是反应物的状态和反应的条件,选择收集装置的依据是被收集气体的溶解性和密度,双氧水制取氧气符合固液不加热型装置的条件,在收集时,氧气密度比空气的密度大且难溶于水 ,故选择的制取装置为B、C(或B、E);该化学反应的表达式为:H2O2 ![]() H2O+ O2;(4)该同学选择的是固固加热型装置,用该装置的制取步骤为查、装、定、点、收、离、熄,故操作步骤为③②①④⑥⑤,若步骤⑤⑥顺序错误,则有可能使水倒流引起试管炸裂。
H2O+ O2;(4)该同学选择的是固固加热型装置,用该装置的制取步骤为查、装、定、点、收、离、熄,故操作步骤为③②①④⑥⑤,若步骤⑤⑥顺序错误,则有可能使水倒流引起试管炸裂。
(二)(1)每个亚硝酸氮分子中含有4个氮原子和6个氧原子,共含有10个原子;(2)亚硝酸氮分子中氧元素与氮元素的质量最简单整数比为:(16![]() 6):(14
6):(14![]() 4)=12:7;(3)亚硝酸氮中氧元素的质量分数=
4)=12:7;(3)亚硝酸氮中氧元素的质量分数=![]() 100%=63.2%
100%=63.2%
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)如何用最简便的方法鉴别氧气、空气、二氧化碳三瓶无色气体?
(2)某同学用下图所示的装置测定空气中氧气的含量, 实验后发现所测定氧气的体积分数低于1/5,简要回答造成这种情况的两种可能原因。

-
科目: 来源: 题型:
查看答案和解析>>【题目】现将A、B两种物质各10g混合加热,A完全反应,生成8gC和4gD,则参加反应的A与B的质量比为
A. 1:1 B. 2:1 C. 4:1 D. 5:1
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作中错误的是
A. 实验室制取气体,要先对装置的气密性进行检查
B. 过滤时液面要低于滤纸边缘
C. 实验产生的废液应倒入指定的容器内
D. 给玻璃仪器加热时都需垫石棉网
-
科目: 来源: 题型:
查看答案和解析>>【题目】按照给出的示例写出下列化学反应的表达式。
示例:硫在氧气中燃烧:
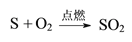
(1)用红磷测定空气中氧气的含量:_________________________________________________。
(2)铁丝在氧气中燃烧:_________________________________________________。
(3)实验室用高锰酸钾制氧气:_________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】质量守恒定律揭示了化学反应中
A. 反应条件 B. 哪些物质是反应物
C. 哪些物质是生成物 D. 反应物和生成物的质量关系
-
科目: 来源: 题型:
查看答案和解析>>【题目】现已探明我国南海海底深处有一种固体——“可燃冰”,其化学成分是甲烷水合物,化学式为CH4·8H2O.下列叙述不正确的是 ( )
A. 可燃冰是由碳、氢、氧三种元素组成的
B. 可燃冰燃烧以后的生成物是二氧化碳和水
C. 可燃冰分子中碳、氢、氧原子个数比为1:20:8
D. 可燃冰分子中CH4和H2O的质量比为1:8
相关试题

