【题目】实验室有一瓶配制数天的Na2SO3溶液,现在对其成分进行检测:
(成分猜想)猜想一:只有Na2SO3;
猜想二:_____;
猜想三:既有Na2SO3,也有Na2SO4。
(查阅资料)①Na2SO3易被空气中的氧气氧化生成Na2SO4.②BaSO4不溶于稀盐酸和稀硫酸。③Na2SO3和盐酸、硫酸反应均生成SO2。
(方案设计)
方案 | 实验操作 | 实验现象 | 结论 |
一 |
①加入足量的稀盐酸 ②再加入足量的BaCl2溶液 | _____ | 猜想三正确 |
二 | ①加入足 ②再加入足量的BaCl2溶液 | 有气体和白色沉淀生成 | 猜想一或猜想三正确 |
(方案分析)
(1)方案一中的实验现象为_____;方案一中加入BaCl2溶液后发生反应的化学方程式为_____。
(2)方案二的设计是否合理:_____(填“合理”或“不合理”);若不合理。理由是_____。
(实验结论)通过分析比较,方案设计_____(填“一”或“二”)合理。
参考答案:
【答案】只有Na2SO4 产生气泡和白色沉淀 产生气泡和白色沉淀 BaCl2+Na2SO4═BaSO4↓+2NaCl 不合理 加入的稀硫酸也会与BaCl2溶液反应,生成白色沉淀,干扰了Na2SO4的检验 一
【解析】
[成分猜想]根据题意分析如下:猜想一:没有变质时只有Na2SO3;猜想二:完全变质时只有Na2SO4;猜想三:部分变质时既有Na2SO3,也有Na2SO4;
[方案设计]加入足量的稀盐酸,再加入足量的BaCl2溶液,产生气泡和白色沉淀,说明溶液中含有亚硫酸钠和硫酸钠;
[方案分析](1)方案一中的实验现象为产生气泡和白色沉淀;方案一中加入BaCl2溶液后,氯化钡和硫酸钠反应生成白色沉淀硫酸钡和氯化钠,发生反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
(2)方案二的设计不合理,理由是加入的稀硫酸也会与BaCl2溶液反应,生成白色沉淀,干扰了Na2SO4的检验;
[实验结论]通过分析比较,方案设计一合理。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学方程式表示下列事实:
(1)纯净的氢气在空气中燃烧:_____。
(2)工业上用一氧化碳和赤铁矿(主要成分是Fe2O3)在高温下炼铁:_____。
(3)服用含氢氧化铝的药物治疗胃酸过多症:_____。
(4)煅烧石灰石制取生石灰:_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是初中化学中常见的仪器装置,请认真观察后回答有关问题:
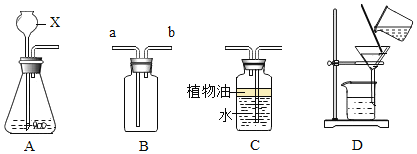
(1)A装置中仪器X的名称:_____。
(2)用B装置来收集氢气时,气体应从_____(填“a”或“b”)端进入。
(3)实验室用C装置来收集CO2,其中在水面上覆盖一层植物油的目的是_____。
(4)用D装置除去粗盐中的杂质时,玻璃棒的下端要斜靠在_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学探究小组的同学准备用碳酸钠溶液与石灰水反应来制取氢氧化钠,并对比NaOH与Ca(OH)2的溶解度。
(1)实验过程:
①把石灰水加入盛有碳酸钠溶液的烧杯中充分搅拌,发生反应的化学方程式:__
②再通过__操作,得到无色滤液.
③将无色滤液通过__操作,得到白色固体.
(2)猜想:得到的白色固体是纯氢氧化钠吗?三位同学分别作出以下猜想:
小玲:是纯净的氢氧化钠!
佳佳:可能还含有碳酸钠!
小强:也可能含有__.
(3)验证:我来验证佳佳的猜想.
实验操作
实验现象
实验结论
取少量白色固体配成溶液,加入足量__
__
__
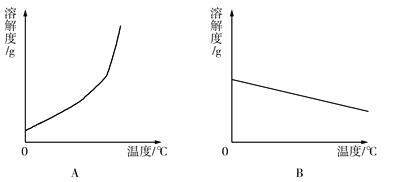
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃
0
20
40
60
80
100
溶解度/g
Ca(OH)
0.19
0.17
0.14
0.12
0.09
0.08
NaOH
31
91
111
129
313
336
(4)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是_________(填A或B)。
(5)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。 其中措施正确的是_____。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(6)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙________甲(填“>”、“<”或“=”)。
-
科目: 来源: 题型:
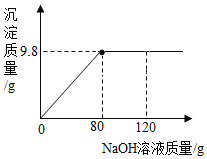
查看答案和解析>>【题目】向一定质量的CuSO4溶液中逐滴滴入NaOH溶液,产生沉淀的质量与所滴入NaOH溶液质量的关系如图所示。当沉淀质量恰好达到最大值时,此时溶液的质量为170.2g。(Cu的相对原子质量为64)试题计算:
(1)CuSO4溶液中溶质的质量-_____。
(2)CuSO4溶液中溶质的质量分数_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道五氧化二磷不能随便排放到空气中,否则会对空气造成污染,所以对该实验进行了改进:
在由两个注射器组成的密闭系统内共有50 mL空气,如图。然后给装有红磷的玻璃管加热。同时交替推动两个注射器的活塞,至玻璃管内的红磷变成白烟,且较长时间内无进一步变化时停止。停止加热后,待冷却至室温将气体全部推至一个注射器内。
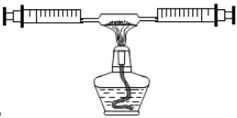
请根据你对上述实验的理解,回答下列问题:
(1)实验结束后,注射器内的气体体积理论上应该减少约_______mL。
(2)在实验的加热过程中,交替缓慢推动两个注射器的目的是____________。写出该反应的文字表达式:__________。
(3)上述实验只是粗略测定空气中氧气含量的一种方法,你认为造成该实验不够精确的可能原因是____________(写出一种即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在下列实验中,观察到的现象或得出结论,完全正确的有
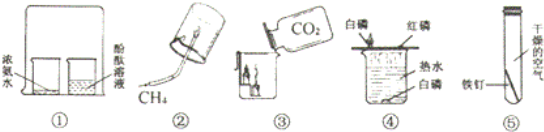
①浓氨水中出现红色,说明氨分子很小且在不断运动
②既能说明甲烷有可燃性,又能说明甲烷是由碳和氢两种元素组成
③既能说明CO2的密度比空气大,又能说明CO2不能燃烧也不支持燃烧
④既能探究可燃物的燃烧条件,又说明白磷的着火点比红磷低
⑤铁钉表面无明显现象,能说明铁生锈的条件是要有氧气和水.
A.2个 B.3个 C.4个 D.5个
相关试题

