【题目】经过监测和治理,我省的土壤质量已经得到了很好的改善,但个别地区仍然存在盐碱地。某校化学兴趣小组的同学们为此开展了实践活动,他们采集了本地的土样,并对土样围绕两个问题进行探究。
查阅资料
①枸杞和合欢均可在轻度盐碱地中生存。
②盐碱地显碱性。
③该土样中的可溶性物质只含NaCl,CaCl2和Na2CO3。
探究过程
(1)甲组探究土样的酸碱度
具体操作是 ,由此得出,该土样的pH>7。
(2)乙组探究土样的成分(如图所示)
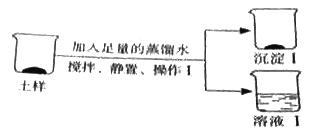
向土样中加入足量的蒸馏水,发生反应的化学方程式 。
同学们对溶液I中的溶质成分很感兴趣,作出如下猜想:
猜想一:只含NaCl
猜想二:含NaCl、CaCl2
猜想三:含NaCl、Na2CO3
设计实验,继续探究:
验证猜想所用试剂 | 实验现象 | 实验结果 | |
方案一 | AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 猜想①正确 |
方案二 | 无明显现象 | 猜想②不正确 | |
方案三 | 猜想③正确 |
反思与评价:
①通过交流,甲组认为乙组的方案一不太严谨,理由是 。
②同学们对沉淀 CaCO3的来源展开了热烈的讨论。一致认为 CaCO3也可能来自土样本身。请解释土样中存在 CaCO3的原因 。
总结与提升:
改良我省的盐碱地,充分利用土地资源,造福山西人民,我们任重而道远。以下建议你认为正确的是
A.轻度盐碱地可以种植枸杞
B.可以用熟石灰改良盐碱地
C.盐碱地应避免施用碱性化肥
参考答案:
【答案】取 pH 试纸于玻璃片上,取少量土样,加入适量水,用玻璃棒蘸取滴在 pH 试纸上,与标准比色卡对比;CaCl 2 +Na2CO3====2NaCl+CaCO3↓;碳酸钠溶液;稀盐酸;有气泡生成;CaCl2也可与AgNO3反应产生白色沉淀,所以该实验不能得出猜想①正确;可能土壤中含有大理石或石灰石;a,c
【解析】(1)测定溶液酸碱度可用pH试纸,方法是:取 pH 试纸于玻璃片上,取少量土样,加入适量水,用玻璃棒蘸取滴在 pH 试纸上,与标准比色卡对比;(2)根据资料“该土样中的可溶性物质只含NaCl,CaCl2和Na2CO3”,溶解后氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,反应的化学方程式表示为CaCl 2 +Na2CO3====2NaCl+CaCO3↓;要证明氯化钙的存在,可向溶液中滴加碳酸钠溶液,若有氯化钙,那么就会反应生成碳酸钙沉淀;要证明碳酸钠的存在,可加入稀盐酸,若有碳酸钠,那么会反应产生大量的气泡;反思与评价:①由于CaCl2也可与AgNO3反应产生白色沉淀,所以该实验不能得出猜想①正确;②石灰石或大理石的主要成分是碳酸钙,故可能土壤中含有大理石或石灰石;a、根据资料“枸杞和合欢均可在轻度盐碱地中生存”,故轻度盐碱地可以种植枸杞,正确;b、盐碱地显碱性,而熟石灰是用于改良酸性土壤,错误;c、盐碱地显碱性,若施用碱性化肥,那么会导致土壤的碱性增强,正确。故选ac 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水体污染主要来自工业废水,农业用水和生活污水。水体被污染,必将影响整个地球的自然环境,对人类产生严重的危害。下图为污水处理流程示意图,污水经物理,化学或生化方法分级处理后,可达到农灌和废水排放标准或绿化和景观用水标准。
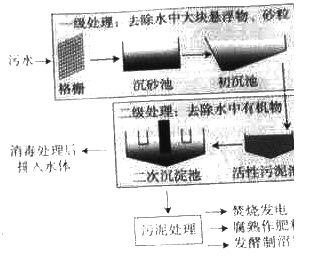
(1)污水通过“格栅”可去除较大的悬浮物、漂浮物,相当于基本实验操作中的 。
(2)污泥处理可得到沼气(主要成分为CH4),写CH4出燃烧的化学方程式 。
(3)消毒处理属于 变化。
(4)消毒处理后的某无色透明水样中含有钾盐,用简单的方法证明此水样为混合物 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列元素名称与元素符号书写都正确的是
A.锌Zn B.硅SI C.氯cl D.贡Hg
-
科目: 来源: 题型:
查看答案和解析>>【题目】6月5日是“世界环境日”,今年中国主题为“践行绿色生活”。下列不属于空气污染物的是
A.氮气 B.一氧化碳 C.PM2.5 D.二氧化氮
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验现象的描述中,正确的是
A.加热试管内的碱式碳酸铜,绿色粉末逐渐变黑,试管口有小水滴
B.细铁丝在氧气中燃烧,火星四射,生成红棕色固体
C.镁条在空气中燃烧,产生黑烟,生成黑色粉末
D.向少量氧化铜中加入稀硫酸,有气泡产生,黑色粉末逐渐消失,溶液变蓝
-
科目: 来源: 题型:
查看答案和解析>>【题目】陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如下,有关说法不正确的是

A.该反应为置换反应
B.反应后硅元素的化合价升高
C.X的化学式是HCl
D.图甲所示物质中硅、氯元素的质量比是14:71
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质属于纯净物的是
A. 盐水 B. 石油 C. 生铁 D. 氢气
相关试题

