
【题目】如图是a、b、c三种物质的溶解度曲线。根据图回答:
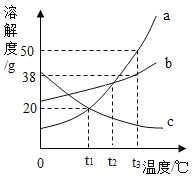
(1)_____℃时,a和c的溶解度相等。
(2)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系为_____(填选项字母,下同);若将温度降低到t1℃时,溶液质量的大小关系为_____。
A c>a=bB b>a=cC a>b>cD b>a>c
(3)在t2℃时,将c物质的不饱和溶液变为饱和溶液,下列有关说法不正确的是_____(填字母)。
A 溶剂的质量可能变小B 溶液的质量可能变大
C 溶质的质量分数一定变大D 溶质的质量一定不变
(4)将纯净的氯化钠配制成溶液。20℃时,向4个盛有200g水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4组实验数据如下:
实验序号 | ① | ② | ③ | ④ |
加入氯化钠的质量/g | 9 | 36 | 81 | 90 |
溶液质量/g | 209 | 236 | 272 | 272 |
若将①中得到的溶液稀释成质量分数为0.9%的生理盐水,需加水的质量是_____g。
关于上述实验的叙述正确的是_____(填序号)。
a、①②所得溶液是不饱和溶液
b、③④所得溶液中,溶质的质量分数不相等
c、20℃时,200g水中最多溶解氯化钠的质量为72g
d、20℃时,将④继续恒温蒸发100g水,过滤,得到质量为36g的固体
(5)现有两种金属单质组成的混合物。向100g某稀盐酸中加入该混合物(假设能与酸反应的的金属都能全部反应),混合物的质量与生成氢气的质量关系如图所示。
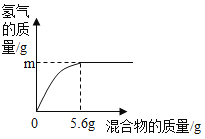
下列说法正确的是_____(填序号)。
a、若混合物为Zn、Al,则m可能是0.2g
b、若混合物为Zn、Cu,则m一定大于0.2g
c、若混合物为Fe、Al,则稀盐酸中溶质质量分数不一定大于7.3%
d、若混合物为Fe、Cu,m为0.1g,则该混合物中Fe的质量分数一定是50%
【答案】t1 C B CD 791 ac ad
【解析】
(1)据图可以看出,在t1℃时,a和c的溶解度相等;
(2)t3℃时,溶解度a>b>c,把20克 a、b、c三种物质分别加入到盛有50克水的烧杯中不断搅拌,a全部溶解,b溶解的质量大于c,故故所得溶液的溶质质量分数大小关系a>b>c,若将温度降低到t1℃时,则t3℃时c中未溶解的固体全部溶解,又ac溶解度一样多,b溶解的最多,溶液质量的大小关系为b>a=c;
(3)A、蒸发溶剂,此时溶质不变,溶剂减少,溶质质量分数变大,故选项说法正确;
B、加入溶质,此时溶质质量变大,溶剂不变,溶质质量分数变大,故选项说法正确;
C、升高温度,溶解度减小,可以变成饱和溶液,溶质和溶剂的量都没变,溶质质量分数不变,故选项说法错误;
D、加入溶质,此时溶质质量变大,溶剂不变,溶质质量分数变大,故选项说法错误;
(4)根据加水稀释前后溶质质量不变可知0.9%的生理盐水中溶质的质量为9g,因此溶液质量为![]() =1000g,因此需加水的质量为1000g-209g=791g;
=1000g,因此需加水的质量为1000g-209g=791g;
分析上述四组溶液,由③组溶液可知200g水中最多溶解72g食盐,因此①②为不饱和溶液,③④为饱和溶液,故a正确;
③④都是该温度下的饱和溶液,因此溶质质量分数相同,故b错误;
由③知,20℃时,200g水中最多溶解氯化钠的质量为72g,故c正确;
20℃时,④中溶液为饱和溶液且剩余18g食盐未溶解,将④继续恒温蒸发100g水,100g水中最多溶解食盐36g,因此过滤得到固体质量应为36g+18g=54g,故d错误;
(5)若混合物全是铁,则铁的质量为5.6 g,则根据化学反应的方程式:Fe+2HCl=FeCl2+H2↑可计算出此时产生氢气的质量等于0.2 g,同理可计算出5.6 gAl与盐酸反应产生氢气的质量大于0.2 g,5.6g锌与盐酸反应产生氢气的质量小于0.2 g,铜和盐酸不反应;
a、若混合物为Zn、Al,m可能等于0.2g,故a正确;
b、若混合物为Zn、Cu,m小于0.2g,故b错误;
c、当混合物为Fe、Al时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6 g铁时,消耗盐酸的质量为7.3 g,所以混合物为Fe、Al时,消耗盐酸的质量大于7.3 g,根据质量分数公式可知所需盐酸溶质质量分数一定大于7.3%,故c错误;
d、若混合物为Fe、Cu,m为0.1g,生成0.1g氢气需要铁的质量是2.8g,则混合物种铁的质量分数![]() ×100%=50%,故d正确。
×100%=50%,故d正确。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】“生命吸管”可直接将污水净化为饮用水,主要处理步骤与自来水的净化过程相似,如下图所示:(③中离子交换树脂的主要作用是去除重金属离子、软化水质)

(1)②中活性炭的作用是____(填字母。下同),④中超滤膜的作用是____。
A.去除有害菌和部分病毒 B.吸附杂质 C.除去较大的不溶性杂质
(2)若无生命吸管,取用河水时,要降低水的硬度和杀灭病原微生物,生活中常采取______方法。
(3)有的河水出现水华现象,经检测发现是河水中含有尿素、硫酸钾、磷酸二氢钾等而导致,上述三种物质属于复合肥的是___________。
(4)下列图标表示“国家节水标志”的是___________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关叙述、对应的化学方程式都正确的是( )
A.拉瓦锡测定空气中氧气含量 HgO![]() Hg+O2
Hg+O2
B.甲烷在空气中燃烧 2CH4+2O2![]() CO2+2H2O
CO2+2H2O
C.实验室用锌和稀硫酸反应制氢气 Zn+H2SO4=ZnSO4+H2↑
D.溶洞的形成 CaCO3↓+H2O+CO2↑=CaHCO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置,结合所学化学知识回答下列问题:
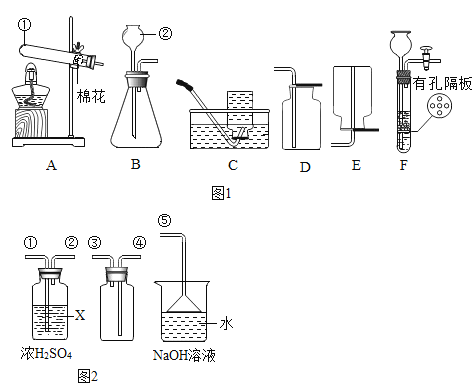
(1)写出有标号的仪器名称:①_____,②_____。
(2)实验室用高锰酸钾制取并收集较纯净O2可选用的收集装置是_____(填字母代号)。
(3)实验室用B、D装置制取CO2的化学方程式为_____,若将发生装置由B改为F,其优点是_____。
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水.SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气.用如图2所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是①→②→④→③→⑤;图中漏斗的作用是_____;烧杯中NaOH溶液的作用_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取 6g试样配成溶液,向其中逐滴加入 CaCl2 溶液,产生沉淀物质的量与所加CaCl2 的物质量关系如图所示。试回答:

(1)试样中碳酸钠的质量分数__________(结果精确至 0.1%)。(要求写出计算过程)
(2)B点时,溶液中的溶质是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家因锂离子电池发展的研究获诺贝尔化学奖。结合图示,有关锂的说法正确的是
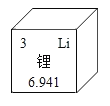
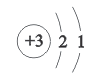
A.属于非金属元素
B.相对原子质量是6.941g
C.![]() 表示核内有3个电子
表示核内有3个电子
D.离子符号是Li+.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答下列问题
(1)从硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如下:
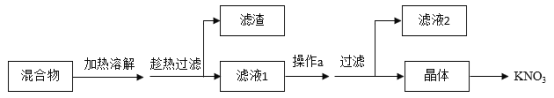
①结合图分析,趁热过滤的原因是___________
②操作a的名称是______
③滤液2的溶质是__________
(2)A~D是初中化学常见物质,A、D为金属,在常温下通过下图所示转化可获得硝酸钾。回答下列问题
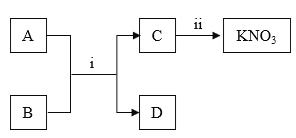
①反应i能发生的原因是______
②若D为银白色贵重金属,则反应i的化学方程式是_____,基本反应类型是_____
③一步实现反应ii,能否加入氯化钾?判断并说明理由________
④硝酸钾可作化肥,能供给作物两种养分,属于_______肥料
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映其对应关系的是( )
A.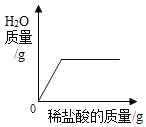 向一定量的氢氧化钠溶液中逐滴加入稀盐酸至过量
向一定量的氢氧化钠溶液中逐滴加入稀盐酸至过量
B.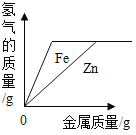 向两份完全相同的稀硫酸中分别加入足量锌粉、铁粉
向两份完全相同的稀硫酸中分别加入足量锌粉、铁粉
C.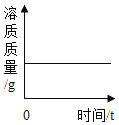 某温度时,向一定量的饱和石灰水中加入过量生石灰,再恢复至原温
某温度时,向一定量的饱和石灰水中加入过量生石灰,再恢复至原温
D. 加热一定质量的高锰酸钾制取氧气
加热一定质量的高锰酸钾制取氧气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质在水中的溶解度曲线.

(1)t1℃时,甲的溶解度 乙的溶解度(填“<”、“>”或“=”).
(2)将t2℃时甲、乙的饱和溶液分别升温至t3℃,甲溶液中溶质的质量分数将 (填“增大”、“减小”或“不变”下同).乙溶液中溶质的质量分数将 .
(3)t2℃时,甲的饱和溶液中溶质的质量m甲与乙的饱和溶液中溶质的质量m乙相比较,
两者的大小关系是 (选填序号).
A、m甲>m乙 B、m甲<m乙 C、m甲=m乙 D、不确定.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com