【题目】人们的生活用水必需经过一系列净化处理才能使用.
(1)河水经过静置、沉淀、______等操作可除去水中不溶性杂质.加放活性炭除去水中的异味,再消毒杀菌可得到自来水.X是一种新型的自来水消毒剂,工业上制取X的化学方程式为:Cl2+2NaClO2═2NaCl+2X,则X的化学式为______.
(2)判断生活用水硬水还是软水,可加入______进行检验.生活中常用______的方法降低水的硬度.
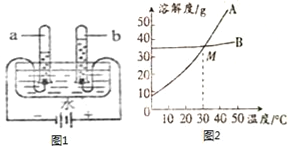
(3)如图1是水通电分解的示意图.该反应的化学方程式为______.
(4)水是最常见的溶剂.氯化钠、碳酸钠在不同温度时的溶解度如下表
物质/溶解度/温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
氯化钠 | 35g | 35.5 | 36g | 36.5 | 37g |
碳酸钠 | 6g | 10g | 18g | 36.5 | 50g |
①依据上表数据,绘制出氯化钠和碳酸钠的溶解度曲线(如图2),图中能表示碳酸钠溶解度曲线的是___________(选填“A”或“B”).
②图中两物质曲线相交于M点,此点表示的意义是______.
③40℃时,把50gA物质放入100g水中,充分搅拌,所得溶液是______溶液(选填“饱和”或“不饱和”).
④生活在盐湖(湖水中主要成分是Na2CO3)附近的人们习惯“夏天晒盐”(NaCl),冬天捞碱(Na2CO3).请你答出“冬天捞碱”的道理______________________.
参考答案:
【答案】 过滤 ClO2 肥皂水 加热煮沸 2H2O![]() 2H2↑+O2↑ A 在30℃时氯化钠和碳酸钠的溶解度相等 饱和 碳酸钠的溶解度随温度的降低减小明显
2H2↑+O2↑ A 在30℃时氯化钠和碳酸钠的溶解度相等 饱和 碳酸钠的溶解度随温度的降低减小明显
【解析】本题主要是考查了水的净化、水的电解及溶解度曲线的运用等。掌握溶解度曲线的意义是解题的关键。
(1)河水经过静置、沉淀、过滤等操作可除去水中不溶性杂质,由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式Cl2+2NaClO2═2NaCl+2X,反应前氯、钠、氧原子个数分别为4、2、4,反应后的生成物中氯、钠、氧原子个数分别为2、2、0,根据反应前后原子种类、数目不变,则2X分子中含有2个氯原子和4个氧原子,则每个X分子由1个氯原子和2个氧原子构成,所以物质X的化学式为ClO2;
(2)判断生活用水硬水还是软水,可加入肥皂水进行检验,加入肥皂水后产生的泡沫较多的是软水,泡沫较少的是硬水.生活中常用加热煮沸的方法降低水的硬度;
(3)水通电分解的化学方程式为:2H2O![]() 2H2↑+O2↑.
2H2↑+O2↑.
(4)①根据表格提供的数据可以看出,碳酸钠的溶解度受温度影响变化较大,故A曲线表示的是碳酸钠的溶解度曲线,;
②图中两溶解度曲线相交于M点,表示在30℃时氯化钠和碳酸钠的溶解度相等;
③40℃时,碳酸钠的溶解度是50g,把50gA物质放入100g水中,充分搅拌,所得溶液是饱和溶液;
④碳酸钠的溶解度随温度的升高变化明显,冬天温度低,碳酸钠在水中的溶解度很小,以晶体的形式析出,故冬天捞碱,故答案为:碳酸钠的溶解度随温度的降低减小明显.
-
科目: 来源: 题型:
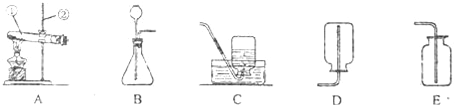
查看答案和解析>>【题目】如图是实验室一些常见仪器装置,根据图回答问题:
(1)写出如图中带标号仪器的名称:①______,②______.
(2)用高锰酸钾制取氧气,选择的装置______(填序号),该反应的化学方程式是__.
(3)实验室制取二氧化碳,应选用的固体药品是_________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系,是化学学科的特点,如图是某化学反应的微观过程示意图(“
 ”表示氧原子,“〇”表示氢原子).
”表示氧原子,“〇”表示氢原子).
(1)从宏观角度看,物质C属于 (选填“混合物”或“纯净物”);
(2)以上变化的基本反应类型是 ;
(3)从微观角度看,物质B是由 构成的(选填“分子”或“原子”或“离子”);
(4)参加反应的A与B的微粒个数比为 .
-
科目: 来源: 题型:
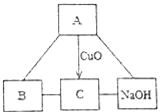
查看答案和解析>>【题目】A、B、C是初中化学常见的不同类型的物质,它们之间有如图转化关系,“﹣”表示两种物质相互反应,“→”表示由反应物转化到生成物.A是人体胃液中含有的酸,B为当今年产量最多的金属.回答下列问题:
(1)写出A物质的名称______,B物质的化学式______.
(2)写出B与C溶液反应的化学方程式___________________________.
(3)写出C溶液跟NaOH溶液反应的化学方程式____________________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类社会的发展离不开金属材料,用你学到的化学知识分析下列问题.
(1)物质的性质决定物质的用途.由于铜具有良好的______性,所以铜常用于制作导线.
(2)常见的三种金属被发现和使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟下列______(填序号)关系最大.
①地壳中金属元素的含量;②金属的熔点;③金属的活动性
(3)铝在空气中表现良好的抗腐蚀性能,用化学方程式表示其原因______.
(4)有铜和氧化铜的混合物10g,通入氢气加热至完全反应,冷却后称量剩余固体的质量为8.4g.
①写出氧化铜与氢气反应的化学方程式______________________.
②该混合物中氧化铜的质量为______g.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化中,属于物理变化的是 ( )
A. 米饭变馊 B. 湿衣服晾干 C. 火药爆炸 D. 铁锅生锈
-
科目: 来源: 题型:
查看答案和解析>>【题目】某固体混合物A中可能含硫酸钠、碳酸钠、硝酸钡、氯化铵等物质中的若干种.按如图所示进行实验,出现的现象如图所述(实验过程中所有发生的反应都恰好完全反应).
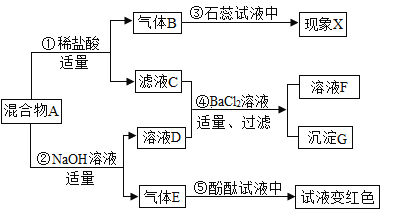
根据实验过程和发生的现象做出判断,填写以下空白:
(1)现象X是______,气体E的化学式为______.
(2)固体混合物A中,肯定存在的物质是______(写化学式).
(3)写出步骤①中发生反应的化学方程式______________________.
(4)仅根据上述实验现象,还不能确定混合物A的组成.为确定混合物A的成分,可用沉淀G再进行实验.方法是取沉淀G少许,向其中加入足量稀硝酸,若沉淀全部溶解,则固体混合物A中不含_____________(化学式).
相关试题

