【题目】神涛同学从一中超市买了一包纯碱,其包装说明如图1所示。他称取了12g纯碱样品溶于水中配制成50g溶液,然后向溶液中滴加70g氯化钙溶液,其产生沉淀的质量与滴加氯化钙溶液的质量关系如图2所示。(发生的反应为:Na2CO3+CaCl2=CaCO3↓+2NaCl)
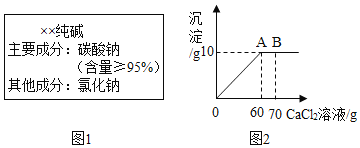
(1)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。__________________
(2)计算A点时,所得溶液中溶质的质量分数。( 计算结果保留一位小数) ________________
【答案】不相符 13.1%
【解析】
解:设样品中碳酸钠的质量为x,反应生成的氯化钠的质量为y
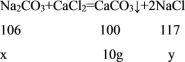
![]() ;
;![]()
解得:x=10.6g y=11.7g
(1)样品中碳酸钠的质量分数为:![]()
所以纯碱样品中碳酸钠的质量分数与包装说明不相符。
(2)A点时,所得溶液中溶质为氯化钠以及未反应的碳酸钠,其质量为:11.7g+(12g-10.6g)=13.1g:
A点时,所得溶液中溶液的质量为:50g+60g-l0g=100g;
A点时,所得溶液中溶液的质量分数为:![]() ;
;
答:(1)纯碱样品中碳酸钠的质量分数与包装说明不相符:
(2)A点时,所得溶液中溶质的质量分数为13.1%。

