【题目】请回忆你和老师共同学习的酸和碱反应的实验探究,并按要求进行实验设计与
(实验探究)
(1)据图设计酸和碱反应:
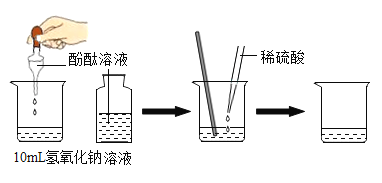
实验步骤 | 实验现象 | 结论 |
①向烧杯中加入 10mL 氢氧化钠溶液,并滴入几滴酚酞试液 | ①溶液颜色_____; | 酸和碱发生了中和反应。 |
②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液 | ②不断搅拌溶液至溶液颜色变成_____色 |
写出硫酸与氢氧化钠反应的化学方程式__________________。
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙两位同学设计了以下方案:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
甲同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
乙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
(实验评价)
①甲、乙两位同学设计的二个方案中,有一个正确的方案,是________(填“甲”“乙” )。
②请分析另一个同学方案错误的原因是__________。
(实验反思)
探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂是(__________)
AFe BCa(OH)2 CCuO DNa2CO3
【答案】变红色 无 2NaOH+ H2SO4= Na2SO4+2H2O 乙 酚酞在酸性、中性环境中都是无色,酚酞不变色,不能确定酸碱恰好完全反应 ACD
【解析】
1、【实验探究】
酚酞遇碱变红色,中性、酸性环境显无色。稀硫酸和氢氧化钠反应生成硫酸钠和水,溶液变成中性,酚酞变成无色,。
实验步骤 | 实验现象 | 结论 |
①向烧杯中加入 10mL 氢氧化钠溶液,并滴入几滴酚酞试液 | ①溶液颜色变红色; | 酸和碱发生了中和反应。 |
②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液 | ②不断搅拌溶液至溶液颜色变成无色 |
硫酸与氢氧化钠反应的化学方程式为2NaOH+ H2SO4= Na2SO4+2H2O。
2、【实验评价】
硫酸能使石蕊变成红色,滴加石蕊,溶液变成红色,说明硫酸过量,乙同学方案正确;酚酞在酸性、中性环境中都是无色,滴加酚酞,酚酞不变色,可能是时酸碱恰好完全反应,溶液显中性;也可能是硫酸过量,溶液显酸性。
①甲、乙两位同学设计的二个方案中,乙同学方案正确。
②请分析另一个同学方案错误的原因是:酚酞在酸性、中性环境中都是无色,不能确定酸碱恰好完全反应。
3、【实验反思】
A、Fe和稀硫酸反应生成硫酸亚铁和氢气,有气泡生成,能够说明硫酸有剩余; B、Ca(OH)2和稀硫酸反应生成硫酸钙和水,没有明显现象,不能判断硫酸是否有剩余; C、CuO 和稀硫酸反应生成蓝色的硫酸铜溶液,能够说明硫酸有剩余;
D、Na2CO3和稀硫酸反应生成硫酸钠、水、二氧化碳,有气泡生成,能够说明硫酸有剩余。
故选ACD。

