【题目】家里蒸馒头的纯碱中含有少量的氯化钠。为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g。(反应方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl)
计算:

(1)反应生成沉淀的质量m为多少?
(2)样品中碳酸钠的质量分数。
(3)滤液中溶质的质量分数。
参考答案:
【答案】(1)10克(2)96.4%(3)5%
【解析】
试题分析:解:(1)反应生成沉淀的质量M为:(11g+100g+141g)-242g=10g
设样品中碳酸钠的质量为x,反应生成的氯化钠质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10g y
106:100 = x:10g 解得:x=10.6g;
样品中碳酸钠的质量分数为 10.6g÷11g ×100%=96.4%
100:117 =10g:y 解得y=11.7g
滤液中溶质的质量分数为(11g-10.6g+11.7g)÷242g ×100%=5%
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图分别是有关二氧化碳制取、干燥,收集和性质检验的装置图。请回答下列问题:
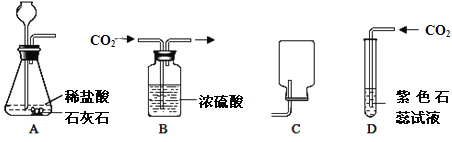
(1)四幅图中错误的是 (填字母序号)。
(2)请写出装置A中反应的化学方程式为
(3)如果实验室用装置A制取氧气,其反应的化学方程式为 。
(4)用B装置干燥二氧化碳时,利用了浓硫酸的 性。
(5)用D装置验证二氧化碳的性质时,反应现象是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳和碳的氧化物是自然界庞大的家族。回答下列问题:
(1)金刚石硬而石墨软,是由于 不同。
(2)由于人类消耗化石燃料的增加和森林的乱乱砍滥伐,使空气中的CO2的含量上从而导致 增强,全球气候变暖。
(3)科学家正在研究将空气中过多的CO2与氢气在催化剂和加热条件下反应,转化为甲烷和水,这个反应的化学方程式是 。
(4)碳的两种氧化物可以互相转化。写出CO2转化为CO的化学方程式: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化工厂排出的废液中含有一定量的AgNO3。化学兴趣小组同学收集了一些该化工厂排出的废液,准备将其中的银以单质的形式进行回收。他们进行了如下的实验活动
【设计方案】
①加入比银活动性强的金属单质;②除去金属混合物中的杂质。
【小组讨论】
①选择加入的金属。甲同学认为:向废液定中加入过量的铜粉,则得到银和铜的金属混合物;乙同学认为:向废液中加入过量的铁粉,则得到银和铁的金属混合物。
你认为 (填“甲”或“乙”)同学的方案更合理,原因是 ;
②除去银粉中混有的金属。向上述所得的金属混合物中加入的试剂是 ,反应的化学方程式为 。
【进行实验】进行实验:实验过程图示如下

操作a是 ,滤液B中溶质的化学式是 ;
【产品验证】
请你设计一种简单的化学实验检验得到的银粉中是否含铁粉: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学实验中经常用到一定溶质质量分数的溶液。请回答:
(1)某同学要在实验室配制15%的氯化钠溶液50g。需要氯化钠的质量为 克,该同学按下图所示步骤依次操作:
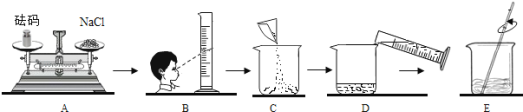
其中操作错误的步骤是 (填字母);E中玻璃棒的作用是 。
(2)若上图A中砝码的质量为5g,游码为2.5g,则该同学称得的氯化钠质量实际为 克。
-
科目: 来源: 题型:
查看答案和解析>>【题目】空气成分中体积分数最大的是( )
A.氧气 B.氮气
C.二氧化碳 D.水蒸气
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~H分别为九年级化学中学过的不同的纯净物,它们存在如下图所示的转化关系。已知A为黑色固体,C为红色固体,常温下B、D、F、G均为无色气体,其中G能使湿润的红色石蕊试纸变蓝。(个别反应的生成物已略去)
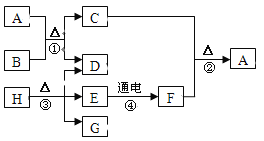
(1)写出化学式:E ,G 。
(2)化合物H的组成元素是: 。
(3)写出反应①的化学方程式: 。
(4)写出反应④的化学方程式 。
相关试题

