【题目】某兴趣小组在制取氧气的实验过程中,有同学联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,于是做出猜想:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应_____(填“能”或“不能”)用于实验室制取氧气。
【分析与反思】
(1)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_____。
(2)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。你认为猜想_____(填序号)一定是错误的,理由是_____
参考答案:
【答案】 不能 加热过氧化钙和水的混合物(或向过氧化钙和水的混合物中加入催化剂) ② 化学反应前后元素的种类不变,而反应前没有碳元素
【解析】本题考查了影响化学反应速率的因素,抓住实验目的、结论,前后联系,进行细致的思考、推断。
实验结论:过氧化钙与水反应生成氧气的速率太慢,所以不能用于实验室制取氧气;
分析与反思:(1)根据过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,由此可知加热过氧化钙和水的混合物有可能会使反应加快,因此实验的改进方法有加热过氧化钙和水的混合物(或向过氧化钙和水的混合物中加入催化剂);
(2)根据质量守恒定律,化学反应前后元素的种类不变,反应物为过氧化钙和水,②的观点认为生成物是碳酸钙和氧气,这样反应物中不含有碳元素,而生成物中含碳元素,不遵循质量守恒定律,所以错误。
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置.下面是该反应的微观示意图,下列说法错误的是
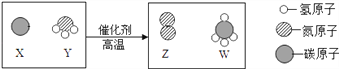
A. 化学反应前后原子的种类、个数、质量均保持不变
B. 该反应不属于置换反应
C. 参加反应的X、Y两物质的粒子个数比为3∶4
D. W物质中碳元素的质量分数为75%
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图中甲—戊是初中化学常见物质。甲、戊为氧化物且甲为黑色固体,乙、丙分别是酸或碱中的一种。(图“—”表示相连的物质间可发生反应,“→”表示一种物质可转化为另一种物质,反应条件、部分反应物与生成物均已略去)。下列说法中不正确的是

A. 乙溶液能使紫色石蕊溶液变红 B. 丙溶液能与戊反应生成丁
C. 甲→戊只能通过置换反应实现 D. 不能由甲通过一步反应生成丁
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命的源泉,也是不可缺少的资源。
(1)某矿泉水的主要矿物质成分及含量如表:
成分
Ca
K
Zn
F
含量(mg/L)
20
3
0.06
0.02
这里Ca、K、Zn、F是指_____ (填“单质、元素、分子或原子”)。
(2)水污染日益严重,水资源的保护和合理利用已受到人们的普遍关注。请参与讨论下列有关问题:
(Ⅰ)检验某地下水是硬水还是软水,可用的物质是_____;实验室常用_____的方法来降低水的硬度
(Ⅱ)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如图所示:
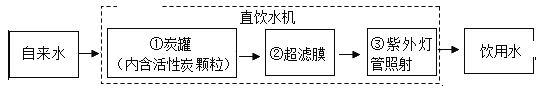
①对应的作用是_____(填字母序号)③对应的作用是_____。
A.杀菌消毒 B.吸附杂质 C.沉淀过滤 D.蒸馏
(Ⅲ)下列做法会造成水体污染的有_____。
A.工业废水直接排放 B.工业废气处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据如图A、B所示的化学实验(装置B铁架台已略去),回答以下问题。
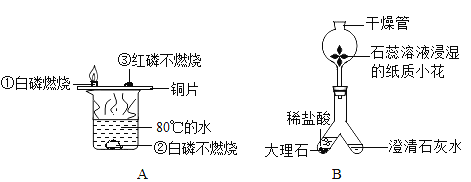
(1)装置A中,对比现象①③说明燃烧需要_____条件;实验中水在其中的作用是_____、_____。
(2)装置B是二氧化碳的制备和性质实验。实验进行一段时间后,“人”字管右端可以观察到的现象是_____,该反应的化学方程式为_____。
(3)装置B的干燥管中被石蕊溶液浸湿的纸质小花的颜色变化为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某氢氧化钠固体样品,可能含有固体氢氧化钾和不溶于酸的杂质A,取5.6g该样品与100g一定质量分数的稀盐酸反应,两者恰好完全反应,生成mg水。下列说法正确的是
A. 若样品不含任何杂质,则m < 1.8
B. 若m =1.8,则样品中一定含有杂质A,可能含有固体氢氧化钾
C. 若m =1.8,则样品中至少含有杂质A或固体氢氧化钾中的一种
D. 若样品中既含有A,也含有固体氢氧化钾,则一定m > 1.8
-
科目: 来源: 题型:
查看答案和解析>>【题目】初中化学中几种常见物质之间的相互转化关系如下图所示。已知常温下B、C为气体,且B是植物进行光合作用的一种重要原料;D、F均为无色液体,都由两种相同的元素组成,且分子中原子个数比依次为2:1和1:1;E为黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去)。下列有关判断正确的是( )
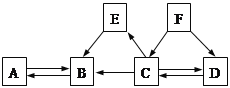
A. E转变为B一定是置换反应
B. A不一定是含CO32-或HCO3-的盐
C. D、F中相同元素的化合价一定相同
D. 除去B中混有的少量C,可以将混合气体通过盛有NaOH溶液的洗气瓶
相关试题


