【题目】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
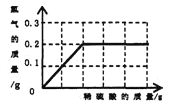
(1)样品中铜的质量分数;(3分)
(2)反应所消耗的硫酸溶液质量;(6分)
(3)反应后所得溶液中溶质的质量分数。(6分)(精确到百分之零点一)
参考答案:
【答案】(1)67.5%(2)100g(3)15.1%
【解析】
试题分析:根据图示看过程中共产生的氢气质量为0.2克,金属中只有锌能够和酸反应,所以设锌的质量为X,Zn+H2SO4ZnSO4+H2↑
65 2
X 0.2克
列比例式得65:X=2:0.2克求得X=6.5克,则铜的质量=20克-6.5克=13.5克,样品中铜的质量分数=13.5克/20克×100%=67.5%;设过程中反应所消耗的硫酸的质量为Y,同时产生的硫酸锌的质量为Z,
Zn+H2SO4ZnSO4+H2↑
98 161 2
Y Z 0.2克
列比例式得:98:Y=161:Z=2:0.2克解得Y=9.8克Z=16.1克,所以反应所消耗的硫酸溶液质量=9.8克/9.8%=100克,反应后所得溶液中溶质的质量分数=16.1克/(100克+6.5克-0.2克)×100%=15.1%
-
科目: 来源: 题型:
查看答案和解析>>【题目】将无色液体A和黑色的粉末B混合,产生一种无色无味的气体C;把红热的银白色的金属细丝D放入盛有C的集气瓶中,D剧烈燃烧、火星四射,生成一种黑色固体F,试回答:
(1)写出上述物质的名称:
A ,B , F 。
(2)写出上述有关反应的符号表达式,并在后面的括号内注明反应的基本反应类型:
① ,( );
② ,( )。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室欲配制1 000 g溶质质量分数为4%的氢氧化钠溶液。请回答下列问题;
(1)配制步骤
①计算:需氢氧化钠固体 g,水 mL(水的密度是1 g/cm3)。
②称量:用质量为23.1 g的烧杯作称量容器,托盘天平上称取氢
氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘。
③溶解:将氢氧化钠固体溶于水,用——搅拌,使氢氧化钠全部溶解,冷却至室温。
④装瓶:把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
请在装有所配制溶液的试剂瓶(见右图)标签上标明相应的信息。
(2)在配制过程中,导致溶液中氢氧化钠质量分数小于4%的可能原因是( )
①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘称取氢氧化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数;④盛装溶液的试剂瓶用蒸馏水润洗;⑤氢氧化钠固体不纯。
A.①②③④⑤ B.只有①②④⑤ C.只有①②⑧ D.只有②③④⑤
(3)若老师提供的药品有500 g 8%的氢氧化钠溶液,500 g 1%的氢氧化钠溶液,足量的氢氧化钠固体和水,除了上述配制方案外,你还可以设计出哪些配制方案,请你写出其中的一种: (只要说明配制时所需的各种药品及用量即可)。(3分)
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化铝[Al(OH)3]受热易分解,产生水并吸收热量,故可作阻燃剂;能与盐酸、NaOH溶液反应,是药物“复方胃舒平”的主要成分之一.实验室制备Al(OH)3方法为:Al2(SO4)3+6NH3H2O═2Al(OH)3↓+3(NH4)2SO4,通常不选用NaOH.下列判断不正确的是( )
A.氢氧化铝的化学性质稳定
B.复方胃舒平可用于治疗胃酸过多症
C.氢氧化铝可灭火的原因之一是降低了可燃物的温度
D.实验室不用NaOH溶液制备Al(OH)3,因为NaOH会与Al(OH)3反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】与元素化学性质关系最密切的是( )
A.=中子数 B. 质子数 C. 核外电子数 D. 最外层电子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图.下列叙述正确的是
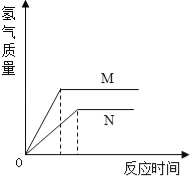
A. 金属的活泼性N>M
B. 两个反应生成H2的体积相等
C. 相对原子质量N>M
D. 两个反应消耗盐酸的质量一定相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是
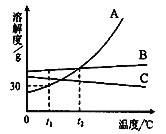
A.t1℃时,A的饱和溶液65 g中含有溶剂50 g
B.要从B溶液中得到B,通常可采用蒸发溶剂使其结晶的方法
C.在t2℃,A、B两种溶液中溶质的质量分数相同
D.将t2℃ ,A、B、C三种物质的饱和溶液降温至t1℃时,C溶液中溶质的质量分数保持不变
相关试题

