【题目】根据下图中所示装置回答下列问题。

A B C D E、
(1)图中仪器a的名称 ,
(2)用大理石和稀盐酸制取二氧化碳时,可选用的发生装置和收集装置是 (填字母,下同),并写出此反应的化学方程式 。
(3)用高锰酸钾制取氧气时,装置A还需要做的一点改动是 。要收集一瓶较纯净的氧气应选用的装置是 。
(4)实验室制取氢气可选用的发生装置和收集装置是 。
参考答案:
【答案】(1)长颈漏斗;(2)BE ;CaCO3 + 2HCl == CaCl2 + H2O +CO2↑;(3)试管口加小团棉花;C ;
(4)BC或BD
【解析】
试题分析:(1)常见仪器的名称可知:仪器a为长颈漏斗;(2)用大理石和稀盐酸制取二氧化碳是固体与液体常温下反应生成气体,故选B作发生装置,因为二氧化碳能溶于水,密度比空气大,应选用向上排空气法收集,选用装置E收集;CaCO3 + 2HCl == CaCl2 + H2O +CO2↑;(3)高锰酸钾制氧气是高锰酸钾受热分解生成气体,需要在试管口处放一团棉花,防止高锰酸钾粉末进入导气管堵塞导气管;氧气可以用向上排空气法和排水法收集,但排水法收集更纯净;(4)氢气难溶于水,可用排水法收集;氢气密度比空气小,可用向下排空气法收集。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
反应前
反应后
实验数据
烧杯的质量/g
稀盐酸的质量/g
混合物样品的质量/g
烧杯和其中混合物的质量/g
40.6
123.4
12
171.6
(1)反应生成二氧化碳的质量为 g;
(2)样品碳酸钠的质量分数是多少?(最后结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关物质用途的表述错误的是
A.铜可用作导线 B.葡萄糖可用于提供能量
C.明矾能够消毒杀菌是利用了明矾很强的氧化性 D.活性炭可以用于自来水的净化
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙两种固体物质的溶解度曲线,下列说法中正确的是
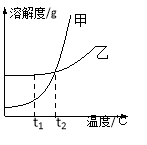
A.将等质量的甲、乙的饱和溶液分别由t2℃降温至t1℃,析出甲多
B.t2℃时,甲、乙两溶液中溶质的质量分数相等
C.将甲溶液从t2℃降温到t1℃时,一定有晶体析出
D.将t2℃时乙的饱和溶液变为不饱和溶液,可采取降温的方法
-
科目: 来源: 题型:
查看答案和解析>>【题目】某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:

(1)操作a的名称是_______。
(2)在操作b中需用玻璃棒不断搅拌,其作用是 。
(3)写出流程中固体的成分 (写化学式),写出加入过量A时反应的化学方程式:____________________________,写出加入适量B时反应的化学方程式_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
次 数
1
2
3
4
加入稀硫酸质量/g
50
50
50
50
剩余固体质量/g
8.5
7
6.6
6.6
(1)铜镁合金中铜的质量。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】U是重要的核工业原料,已知U中质子数为92,中子数为143,则U的核外电子数是
A.143 B.92 C.235 D.51
相关试题

