【题目】FeCl3(氯化镁)溶液能对过氧化氢的分解也起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
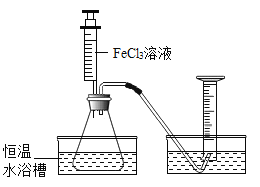
Ⅰ.分别取相同体积、相同浓度的FeCl3溶液,如图观察到____________,就可以粗略判断,得出实验结果,为进一步判断上述实验结论的准确性,作用图示装置,小刚同学进行了如下实验方案设计进行定量研究。
Ⅱ.[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间。
[方案二]在不同过氧化氢浓度下,测定_________________________________;
方案二的实验测量结果:

其中x_______,y________.
通过测量,若V1_______V2(填“>”、“=”或“<”),得出的实验结论为:_____________.
参考答案:
【答案】 水槽中产生气泡的速率和量筒中水的下降速率(答案合理给分,下同) 相同时间收集的气体的体积 3 5 < 过氧化氢浓度越大,相同时间收集的气体体积越多
【解析】Ⅰ、可以通过 气泡生成的速度或量筒中水的下降速率,就可以粗略判断,得出实验结果;Ⅱ、[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间;[方案二]在不同过氧化氢浓度下,测定 相同时间收集的气体的体积;方案二的实验测量结果(这个数据要看的懂才能很好理解,选用的是同一种质量分数的过氧化氢溶液,不同的体积,但是采取加入水而最后溶液的体积还是相等的,也就是表格中第二列和第四列之和相等,此时溶液体积相等,但是溶质的质量分数不同,由于是不同浓度下的过氧化氢,所以加入的氯化铁溶液体积也应该相同,相同时间产生的氧气的体积多少,所以反应时间也相同)所以表中x=3,y=5;实验结论:通过测量,若V1<V2(填“>”“=”或“<”),说明 反应物的浓度越高,反应速度越快,相同时间收集的气体体积越多。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是某同学设计的某些实验装置,回答下列问题:
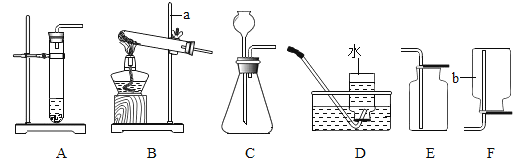
(1)写出图中仪器a和b的名称:a__________;b_________.
(2)用过氧化氢和二氧化锰制取氧气可选用的发生装置是________,收集装置可选用__________,反应的文字表达式为:_________________________________________.
(3)C装置检查气密性的方法是(可借助图中其他仪器)_____________________________.
(4)①实验室用高锰酸钾制取并收集氧气可采用的装置组合是_________,反应的符号表达式为________________________________________________.
②实验室用高锰酸钾制取并收集氧气的主要操作有:
①从水槽中撤出导管;②收集气体;③固定装置;④检查装置的气密性;⑤加热;⑥撤酒精灯;⑦装药品,正确的操作顺序是_________
A.④⑦③⑤②①⑥ B.⑦④③⑤②①⑥
C.①②③④⑤⑥⑦ D.④⑦③⑤②⑥①
在完成“②收集气体”步骤时,应当_______________时收集气体。
③实验室用高锰酸钾制取并收集氧气,需要在试管口派一团疏松的棉花,其作用是________________________.
(5)对比上述两种制取氧气的方法,从安全、节能、环保、简便等方面考虑,实验室制取氧气的反应物最好用_______________(填“高锰酸钾”或“过氧化氢”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组的同学,课下对蜡烛的燃烧和空气中氧气含量的测定又进行了系列的探究,请你参与并回答下列问题。
【发现问题1】点燃蜡烛,发展蜡烛火焰的明亮程度不一样,是什么原因所致呢?
【猜想与假设1】猜想①:蜡烛中可燃物成分不一样;猜想②:________________________.
【发展问题2】同学们用蜡烛代替红磷测定空气中氧气的含量,发现蜡烛很快熄灭,回流到集气瓶中的永远小于瓶容积的1/5。是什么原因所致呢?
【猜想与假设2】猜想①:蜡烛燃烧产生CO2气体;
猜想②:___________________________________;
猜想③:___________________________________.
【实验验证】将蜡烛点燃后用氧气传感器定量测定瓶中的氧气含量。数据如下图。
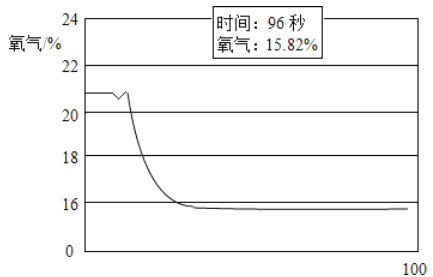
【得出结论】此实验中空气中氧气体积分数降低了_________%。
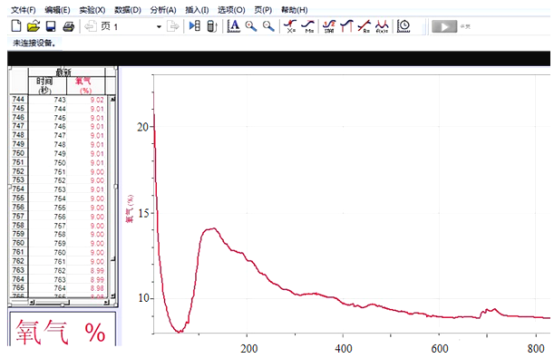
【深入探究】合肥某中学化学老师用氧气传感器定量测定密闭条件下足量红磷燃烧时氧气的含量变化,如图,在110秒时氧气的含量有所上升,接着再慢慢下降,最终维持在8.85%左右。请你试着解释图象变化的可能原因是:___________________________________
【拓展研究】你对氧气含量最终维持在8.85%左右是怎么理解的?________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】写出下列反应的文字或符号表达式。
(1)硫在空气中燃烧__________(基本反应类型_________);
(2)木炭在氧气中燃烧__________________________;
(3)氯酸钾制取氧气_____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据A、B、C三种粒子的结构示意图,回答下列问题:
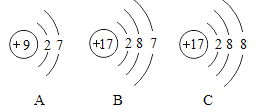
①A所表示的元素位于元素周期表的第________周期,C是氯元素对应的粒子,其符号是____.
②A、B、C中属于同种元素的粒子是_______;A和B两种粒子的______;相同,所以它们具有相似的化学性质。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列四个图象能正确反映其对应实验操作的是
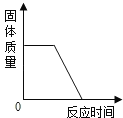
A.高温煅烧一定质量的石灰石
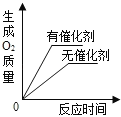
B.用等质量、等浓度的双氧水分别制取氧气

C.向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
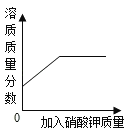
D.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
-
科目: 来源: 题型:
查看答案和解析>>【题目】松花皮蛋是我们喜爱的食品。某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等。同学们对料泥进行了如下探究:
【猜想】猜想I:料泥的主要成份是Ca(OH)2、NaOH、KOH、Ca CO3、灰份;
猜想Ⅱ:料泥的主要成份是NaOH、KOH、Na2CO3、CaCO3、灰份。
【实验与现象】实验过程与现象如下图:
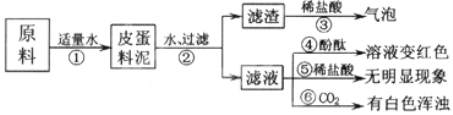
【问题与讨论】
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、_________,玻璃棒在步骤②中的作用是_______________________。
(2)步骤③的现象说明滤渣中含有:_________________________________(写化学式)。
(3)请写出步骤①发生的任意两个反应的化学方程式:___________________、________________________________。
(4)由上述实验现象推断,猜想______________________是正确的。
相关试题

