【题目】某化学兴趣小组在学习金属知识后,对金属钙及其化合物的化学性质非常感兴趣,并进行了以下实验探究。
(1)对金属钙的化学性质进行探究
(提出问题)金属钙能否与水反应?
(实验探究)取一粒金属钙投入盛有50mL水的烧杯中,钙粒与水剧烈反应,四处游动,产生气泡,溶液出现浑浊,用手触摸烧杯外壁,感觉发热。反应结束放置一段时间后,溶液变澄清,往烧杯中滴入无色酚酞试液,溶液变红色。
(实验结论)金属钙能与水反应。经进一步检验,产生的气体能燃烧。请写出钙与水反应的化学方程式___。
(交流与反思)反应结束放置一段时间后,溶液变澄清的原因是___。
(2)对久置于空气中的“生石灰”干燥剂的组成成分及含量进行探究
(查阅资料)Ca(OH)2加热到一定温度时会发生分解反应,生成两种氧化物。
(实验探究)该小组称取10.0g干燥剂样品于控温电加热器中,按如图所示装置进行实验(装置气密性良好,装置A、B、C中药品足量,实验操作正确)
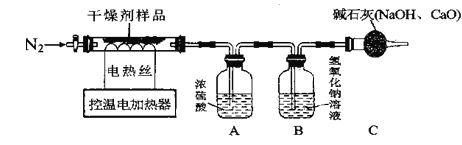
(实验数据记录)充分反应后,产物被完全吸收,A装置增重0.9g,B装置增重2.2g
(分析与结论)该包干燥剂的成分有____(填化学式),其中Ca(OH)2的质量为___g。
(反思与拓展)
①停止加热后,需要通入N2一段时间的目的是___。
②若没有C装置,会导致含量测定结果偏小的成分是___。
【答案】Ca+2H2O═H2↑+Ca(OH)2 温度降低氢氧化钙溶解度增大,不能溶解的氢氧化钙全部溶解 CaO、Ca(OH)2、CaCO3 3.7 使反应生成的水、二氧化碳全部被浓硫酸、氢氧化钠溶液吸收 氧化钙
【解析】
(1)实验结论:
金属钙能与水反应。经进一步检验,产生的气体能燃烧,由质量守恒定律可知,该气体是氢气,因此钙与水反应生成氢氧化钙和氢气,反应的化学方程式:Ca+2H2O═H2↑+Ca(OH)2;
交流与反思:
反应结束放置一段时间后,溶液变澄清的原因是温度降低氢氧化钙溶解度增大,不能溶解的氢氧化钙全部溶解;
(2)分析与结论:
A装置中浓硫酸具有吸水性,增重0.9g,B装置中氢氧化钠能吸收二氧化碳,增重2.2g,说明氢氧化钙分解生成了0.9g水,碳酸钙分解生成了2.2g二氧化碳;
设:生成0.9g水需要氢氧化钙的质量为x。
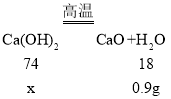
![]() x=3.7g;
x=3.7g;
设:生成2.2g二氧化碳需要碳酸钙的质量为y。

![]() y=5.0g;
y=5.0g;
干燥剂中氧化钙质量=10.0g-3.7g-5g=1.3g,
该包干燥剂的成分有CaO、Ca(OH)2、CaCO3,其中Ca(OH)2的质量为3.7g
反思与拓展:
①停止加热后,需要通入N2一段时间的目的是使反应生成的水、二氧化碳全部被浓硫酸、氢氧化钠溶液吸收;
②若没有C装置,会导致空气中的部分二氧化碳进入B装置中,导致测定的二氧化碳质量偏大,由于氢氧化钙的测定值不变,因此含量测定结果偏小的成分是氧化钙。

