【题目】同学们利用“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
【实验探究】
(1)A、B、C、D四组同学分别进行了下列实验
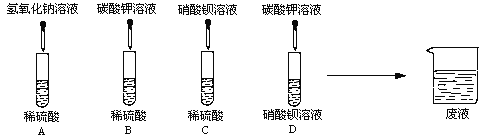
写出下列的两个化学方程式:
①A中的反应
②D中的反应
【挖掘实质】
下图是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O
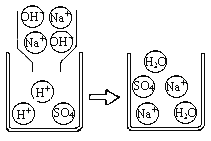
【实践运用】
完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,用无色溶液滴加紫色石蕊试剂,变为红色。
(1)①溶液中的白色沉淀一定是 ,理由是
(2)废液中一定不含有的离子是
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有 | ②取滤液滴加 | 现象明显 | 含有该离子 |
参考答案:
【答案】(1)①H2SO4+2NaOH==Na2SO4+2H2O
②K2CO3+Ba(NO3)2==BaCO3↓+2KNO3
【实践运用】(1)硫酸钡。BaSO4与酸不反应,而BaCO3要与酸反应
(2) OH- CO32-
(3) 可能含硫酸根离子
溶液中可能有的离子 | 实验步骤 |
①可能含硫酸根离子 | ②向滤液中加入硝酸钡(或氯化钡、氢氧化钡等) |
(二)可能含钡离子
溶液中可能有的离子 | 实验步骤 |
①可能含钡离子 | ②向溶液中加入稀硫酸(或硫酸钠等)溶液 |
【解析】
试题分析:(1)①根据图示可知:试管A中的稀硫酸能与加入的氢氧化钠中和反应生成盐和水,化学方程式为:H2SO4+2NaOH==Na2SO4+2H2O
②D为碳酸钾加入硝酸钡中,二者可发生复分解反应生成碳酸钡沉淀和硝酸钾,反应的化学方程式为:K2CO3+Ba(NO3)2==BaCO3↓+2KNO3
【实践运用】
(1)因题目中的反应发生在硫酸、氢氧化钠、硝酸钡和碳酸钾之间;其中氢氧根离子能和氢离子结合形成水分子(A中);碳酸根离子可与氢离子结合形成水分子和二氧化碳分子(B中);碳酸根离子也可与钡离子结合形成碳酸钡沉淀(D中)。当“废液中出现白色沉淀”时,该沉淀一定为钡的沉淀。其中硫酸钡和碳酸钡均为沉淀。由于 “加入紫色石蕊试液时,变为红色”,说明溶液呈酸性,即含较多的氢离子。因为碳酸钡可与酸反应,而硫酸钡不与酸反应。所以沉淀只有硫酸钡。
(2)向溶液中“加入紫色石蕊试液时,变为红色”,说明溶液呈酸性,即含较多的氢离子。由于氢离子能和氢氧根离子结合形成水分子;可与碳酸根离子结合形成水分子和二氧化碳分子;所以氢氧根离子和碳酸根离子一定不存在。
(3)根据题意可知:钠离子和硝酸根离子未形成沉淀或气体,所以一定存在于所得的溶液中。结合上面的分析可知:所得溶液中一定含氢离子、钠离子和硝酸根离子,一定不含氢氧根离子和碳酸根离子。而在“实践运用”中所得的沉淀是由硫酸根离子和钡离子形成的。所以无法确定所得到的溶液中是否含硫酸根离子或钡离子。即溶液中可能含的离子为硫酸根离子或钡离子(二者只含其一)。因此,实验应为:
(一)可能含硫酸根离子
溶液中可能有的离子 | 实验步骤 |
①可能含硫酸根离子 | ②向滤液中加入硝酸钡(或氯化钡、氢氧化钡等) |
(二)可能含钡离子
溶液中可能有的离子 | 实验步骤 |
①可能含钡离子 | ②向溶液中加入稀硫酸(或硫酸钠等)溶液 |
-
科目: 来源: 题型:
查看答案和解析>>【题目】.关于“化学”的认识,错误的是
A.化学能创造自然界不存在的新型材料 B.化学能为人们战胜疾病,合成新药
C.化学在环境保护中起着重要作用 D.化学发展必然带来人类生存环境的恶化
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一包白色粉末可能由NaCl、NaNO3、MgCl2、CuSO4、中的一种或多种物质组成。小明为了探究其成分,设计并完成了如下图所示的实验。
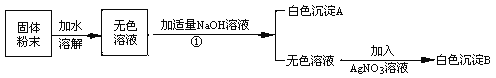
根据以上实验,回答:
操作①是
原固体粉末中一定没有的成分是
生成沉淀A的化学方程式是
根据上述实验 (填‘能’或‘不能’)确定原固体粉末中含有NaCl、NaNO3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的性质决定物质的用途。下列物质的用途中,利用其化学性质的是( )
①氢气用于填充气球 ②一氧化碳用作燃料 ③氧气用于气焊 ④干冰用作制冷剂
A. ①② B. ②③ C. ②④ D. ②③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
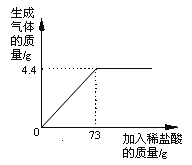
(1)纯碱恰好完全反应时,生成CO2的质量为 g
(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?
-
科目: 来源: 题型:
查看答案和解析>>【题目】将40克质量分数为10%的氢氧化钡溶液与20克质量分数为20%的盐酸溶液混合后,再加入下列物质:①AgNO3 ②Cu(NO3)2 ③NaOH ④Na2SO4,一定能发生反应的是( )
A. ①②③ B. ①②④ C. ②③④ D. ①③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】 登山运动员常利用氢化钙固体作为能源提供剂,在需要时与水反应生成其他物质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:

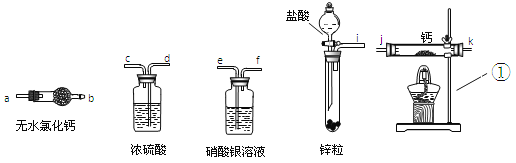
A B C D E
查阅资料:(1)钙易与水反应生成碱和气体。
(2)无水氯化钙能作干燥剂。
(1)请写出E图中仪器①的名称 。
(2) 请按气流方向连接顺序i接( ),( )接( ),( )接( ),k接 a
(填仪器接口的字母编号)。写出C中可能发生的化学方程式 。
(3)实验结束后,某同学取少量生成物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验的确有CaH2生成。另一位同学认为该同学的判断不准确,原因是 。
(4)氢化钙作为能源提供剂,与直接用氢气相比,其优点是
相关试题

