【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
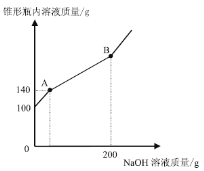
(l)反应至A点时加入氢氧化钠溶液的质量为__________;
(2)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为多少?(计算结果保留至0.1%)
【答案】(1)40g(1分);(2)10.4%
【解析】向盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,氢氧化钠先与盐酸反应生成氯化钠和水,后剩余的氢氧化钠再与氯化铜反应生成氢氧化铜沉淀和氯化钠;据质量守恒定律可知反应前后物质的总质量不变,所以(l)反应至A点时加入氢氧化钠溶液的质量为40g;设反应至B点时生成沉淀的质量为x,
CuCl2+2NaOH==2NaCl+Cu(OH)2↓
80 98
160g×10% x
80/160g×10%=98/x x=19.6g
反应至B点时锥形瓶内所得溶液的质量为:200g+100g-19.6g=280.4g;
生成氯化钠的总质量为:200g×10%×![]() /
/![]() =29.25g
=29.25g
反应至B点时锥形瓶内所得溶液的溶质质量分数29.25g÷280.4g×100%≈10.4%
答:略

