【题目】根据下列实验装置图,回答有关问题,
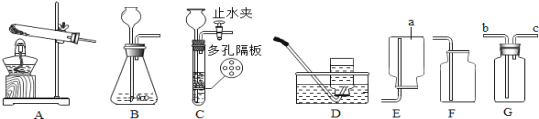
(1)装置图中仪器a的名称为 。
(2)用氯酸钾和二氧化锰混合共热制取氧气,可选用的装置组合是 ,写出发生反应的化学方程式 。若改用高锰酸钾制取氧气,发生装置应作的改动是 。
(3)实验室利用B装置制取二氧化碳的化学方程式为 ,
如果利用G装置收集二氧化碳,气体应从 端通入(填“b”或“c”),用C装置代替B装置作为发生装置,其主要优点是 。
(4)某学生想要通过碳酸氢铵分解产生的氨气来探究氨水具有碱性,而氨气不具有碱性,按下图所示进行实验:(滤纸条用酚酞试液浸泡并晾干)
[资料] NH4HCO3![]() NH3↑+H2O+CO2↑ 2NH3+H2SO4 ====(NH4)2 SO4
NH3↑+H2O+CO2↑ 2NH3+H2SO4 ====(NH4)2 SO4

试分析:A装置中加入浓硫酸的作用是 ,B中氢氧化钠固体的作用是:Ⅰ.干燥气体;Ⅱ. (用化学方程式表示),该同学看到 现象,得出了正确的结论。
参考答案:
【答案】(1)集气瓶(2)AD;AF;2KClO3![]() 2KCl+3O2↑;试管口处放棉花 (3)CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;b;能够控制反应的开始和停止(4)浓硫酸溶于水放热,提供热量;2NaOH + CO2=== H2O + Na2CO3 ,干燥的滤纸条不变红,湿润的滤纸条变红
2KCl+3O2↑;试管口处放棉花 (3)CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;b;能够控制反应的开始和停止(4)浓硫酸溶于水放热,提供热量;2NaOH + CO2=== H2O + Na2CO3 ,干燥的滤纸条不变红,湿润的滤纸条变红
【解析】
试题分析:用氯酸钾和二氧化锰混合共热制取氧气,可选用的装置组合是AD或者AF,因为过程中要加热,所以发生装置为A,因为氧气的密度大于空气,且难溶于水所以收集装置是D或者F,发生反应的化学方程式2KClO3![]() 2KCl+3O2↑;。用高锰酸钾制取氧气,发生装置应作的改动是试管口需要棉花。实验室利用B装置制取二氧化碳的化学方程式为CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O,如果利用G装置收集二氧化碳,气体应从b端通入因为氧气的密度大于空气,用C装置代替B装置作为发生装置,其主要优点是能够控制反应的开始和停止;A装置中加入浓硫酸的作用是浓硫酸溶于水放热,提供热量,B中氢氧化钠固体的作用是:Ⅰ.干燥气体;Ⅱ. 2NaOH + CO2=== H2O + Na2CO3(用化学方程式表示),看到干燥的滤纸条不变红,湿润的滤纸条变红现象,得出了正确的结论,因为氨水具有碱性,而氨气不具有碱性,所以干燥的试纸不会变色。
2KCl+3O2↑;。用高锰酸钾制取氧气,发生装置应作的改动是试管口需要棉花。实验室利用B装置制取二氧化碳的化学方程式为CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O,如果利用G装置收集二氧化碳,气体应从b端通入因为氧气的密度大于空气,用C装置代替B装置作为发生装置,其主要优点是能够控制反应的开始和停止;A装置中加入浓硫酸的作用是浓硫酸溶于水放热,提供热量,B中氢氧化钠固体的作用是:Ⅰ.干燥气体;Ⅱ. 2NaOH + CO2=== H2O + Na2CO3(用化学方程式表示),看到干燥的滤纸条不变红,湿润的滤纸条变红现象,得出了正确的结论,因为氨水具有碱性,而氨气不具有碱性,所以干燥的试纸不会变色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的试验流程(有些反应的部分反应物和生成物已省略).查阅资料发现常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H2O═Na2SiO2+2H2↑).

根据以上信息,回答下列问题:
(1)操作Ⅰ、Ⅱ的名称为 ,硅钢样品反应前须粉碎目的是 ;
(2)滤液B中的溶质为 ;
(3)写出步骤⑦中发生反应的化学方程式 ;其基本反应类型为 ;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】正常人的体液pH都在一个相对稳定的范围内,否则人会生病.下列人体体液中,酸性最强的是
A.唾液(pH:6.67.1) B.血液(pH:7.357.45)
C.胆汁(pH:6.87.4) D.胃酸(pH:0.81.5)
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取氧气的过程,大致分为以下六个主要操作:
①点燃酒精灯,给试管加热;
②熄灭酒精灯;
③检查装置的气密性;
④将高锰酸钾装入试管里,试管口放一小团棉花,用带导管的胶塞塞紧,并将它固定在铁架台上;
⑤用排水法收集氧气;
⑥将导管从水面下取出。
正确的操作顺序是( )
A. ③④①⑤②⑥ B. ③④①⑤⑥② C. ④①③⑤⑥② D. ④①③⑤②⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫酸亚铁是一种重要的食品和饲料添加剂,某补血剂样品【主要成分为硫酸亚铁晶体(FeSO4xH2O)】,某化学兴趣小组对其产生了兴趣并进行了探究:
【探究一】硫酸亚铁晶体(FeSO4xH2O)热分解研究
【查阅资料】
1.无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体;
2.硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
3.二氧化硫能使高锰酸钾溶液褪色。
【进行实验】该兴趣小组同学称取27.8g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行分析,并利用SDTQ600热分析仪,对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示的关系图,试回答:
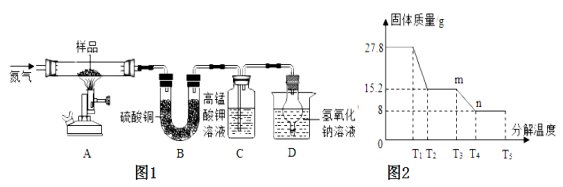
(1)装置B中硫酸铜粉末变蓝,说明产物中有 ,该物质的质量是 g;装置C中高锰酸钾溶液褪色,说明产物中还有 ;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为 。
(2)D装置中球形干燥管的作用是 。
(3)硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,请写出化学反应方程式 。
(4)根据图2中的数据,请求出FeSO4xH2O中的x= 。(不写过程)
【交流讨论】实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
【探究二】补血剂样品中硫酸亚铁的含量:
①取10g补血剂样品研细后溶于40g水中,研细的目的是 ;
②向所配制的溶液中加氯化钡溶液至略过量,使其充分反应;
③过滤,洗涤,干燥,称量所得白色固体的质量为6.99g。
请计算出10g样品中FeSO4的质量分数,写出计算过程。此题2分。
(已知:FeSO4+BaCl2=BaSO4↓+FeCl2,有关相对分子质量:FeSO4—152,BaSO4—233)
-
科目: 来源: 题型:
查看答案和解析>>【题目】运用溶解度表与溶解度曲线,下列说法正确的是
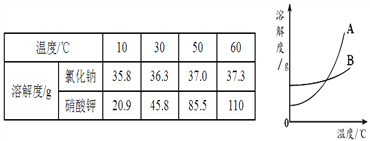
A. B是硝酸钾的溶解度曲线。
B. 将一定量50℃的A、B溶液降温到30℃时,析出的晶体A一定比B多
C. 10℃时,将40g氯化钠溶于100g水中,所得溶液溶质的质量分数约为28.6%
D. 可用冷却热饱和溶液的方法提纯含有杂质B的A
-
科目: 来源: 题型:
查看答案和解析>>【题目】空气中氧气含量测定的再认识。
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点有 。
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气集合耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式 。兴趣小组用该方法测出的氧气含量常常远低于21%。
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气; (2) 装置内氧气有剩余;……
【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因 。
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:
。
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氧化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积
实验后的体积
集气瓶内空气
烧杯内蒸馏水
烧杯内剩余蒸馏水
131mL
90.0mL
63.6mL
请计算出空气中氧气含量 (计算结果保留一位小数)。
【结论与反思】通过上述实验探究,选择 (填物质名称)进行实验,可较为快速地完成实验并减小实验误差。
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由: 。

相关试题

