【题目】兴趣小组的同学想测定某石灰石样品中碳酸钙的质量分数,他们取9克石灰石于烧杯中并慢慢加入盐酸,测得反应过程剩余固体质量与加入盐酸的质量关系如下图所示(石灰石中的杂质不与盐酸反应也不溶于水)
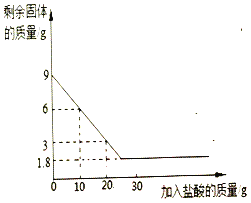
请回答下列问题:
(1)石灰石中所含杂质的质量是_____g
(2)通过计算求所用石灰石中含碳酸钙的质量分数以及生成二氧化碳质量_____、_____(该结果精确到0.1g)
(3)当加入_____克盐酸时,反应恰好停止。
(4)根据以上数据画出产生的气体与加入的盐酸质量的关系图__________。
参考答案:
【答案】 1.8g 80.0% 3.2g 24克 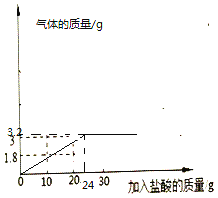
【解析】本题考查了根据化学反应方程式的计算
(1)由图可以看出杂质的质量为1.8g,所以碳酸钙的质量为9g﹣1.8g=7.2g,
(2)所用石灰石中含碳酸钙的质量分数为![]() ×100%=80.0%
×100%=80.0%
设:生成的二氧化碳的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
7.2g x
![]()
x≈3.2g
(3)由图可以看出消耗3g的碳酸钙对应的稀盐酸的质量为10g,进而求算7.2g碳酸钙对应的稀盐酸的质量7.2g×![]() =24g,当加入24克盐酸时,反应恰好停止;
=24g,当加入24克盐酸时,反应恰好停止;
(4)根据以上数据画出产生的气体与加入的盐酸质量的关系图为

-
科目: 来源: 题型:
查看答案和解析>>【题目】兴趣小组的同学从实验室中收集一桶含有Fe2(SO4)3、FeSO4 CuSO4和硫酸的废液。他们想从中制取碳酸亚铁并回收铜。主要步骤如图所示。 查阅资料:Fe2(SO4)3与铁可发生如下反应:Fe2(SO4)3+Fe=3FeSO4
FeCO3沉淀焙烧的反应方程式:FeCO3
 FeO+CO2↑
FeO+CO2↑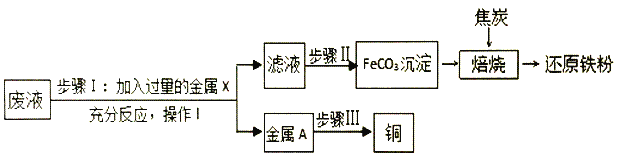
(1)步骤I加入过童的金属X后发生_____个化学反应,这些反应中有的属于化合反应,有的属于_____反应 (填基本反应类型)。
(2)过滤是重要的实验手段,在此流程中需要用到过滤操作的是步骤_____ (填Ⅰ~Ⅲ)。
(3)金属A中的成分有_____,步骤III可以用简单的物理方法得到铜,也可以用化学方法得到,化学
方法的反应方程式是_____。
(4)FeCO3沉淀隔绝空气进行“焙烧”制得还原铁粉的过程是FeCO3
 Feo
Feo Fe,“焙烧”过程中化合价发生改变的元素有_____ (填符号)
Fe,“焙烧”过程中化合价发生改变的元素有_____ (填符号) -
科目: 来源: 题型:
查看答案和解析>>【题目】如下图,分别往A、B两支大试管中加入少量红墨水,其中试管A加入少量的活性炭,振荡,再分别往试管中加入一大团棉花(棉花的量以塞紧试管为宜),用玻璃棒把棉花轻轻推入至试管底部。
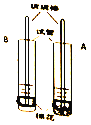
(1)没放棉花前,A试管中的现象是_____;
(2)放棉花后,A试管中的现象是_____,B试管中的现象是_____,棉花的作用是_____;
(3)若只做A试管实验则实验结论不严谨,原因是_____
-
科目: 来源: 题型:
查看答案和解析>>【题目】西红柿是营养极为丰富的食物,它含有一种具有重要生理功效的营养素一番茄红素(C40H56).如图是某牌子番茄红素胶囊的说明,请回答:
(1)番茄红素含有____种元素,各元素质量比为____;每个番茄红素分子中含有___个原子核;
(2)若某健康成年人正在通过食用该胶囊来补充番茄红素,则她每天服用的番茄红素质量为____。

-
科目: 来源: 题型:
查看答案和解析>>【题目】为了除去二氧化碳中的少量氧气,并探究二氧化碳的性质,某同学设计了如图所示这套装置。
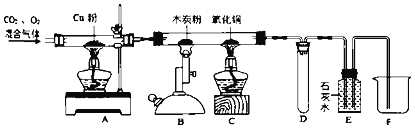
实验步骤
实验现象
现象分析
①点燃A处酒精灯,缓缓通入混合气体
A中硬质玻璃管内固体
___,B、C、D无明显现象,E中石灰水变浑浊。
A硬质玻璃管中铜粉的作用是_____。E中发生反应的化学方程式是___。
②点燃B中酒精喷灯
B中木炭粉减少,E中石灰水浑浊,液面下降。
B硬质玻璃管中发生反应的化学方程式是_____。
③点燃C中酒精灯
C中现象___,E中石灰水变澄清,液面下降
C硬质玻璃管中发生反应的化 学方程式是__
④停止通入混合气体,并用止水夹夹紧进气口,熄灭A,B,C处的酒精灯和酒精喷灯
___ 处有液体导入(填A﹣F)
D装置的作用是__
【拓展与思考】
(1)从步骤②开始E中液面开始下降的原因:_____
(2)有同学认为该装置需要添加尾气处理理装置,你认为是否需要并说明理由:_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,属于置换反应的是
A. 4Fe(OH)2+O2+2H2O==4FeOH)3 B. Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2C. C+H2O
 CO+H2 D. H2SO3=H2O+SO2↑
CO+H2 D. H2SO3=H2O+SO2↑ -
科目: 来源: 题型:
查看答案和解析>>【题目】下图为KNO3的溶解度曲线图,现有M状态下的KNO3溶液65g,若要将该溶液经过处理后,刚好得到该温度下的饱和溶液,下列处理方法正确的是( )
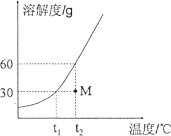
A.在t2℃时,将65g溶液倒出去32.5g
B.将65g溶液蒸发掉32.5g的水,再冷却到t2℃
C.在t2℃时,向65g溶液中加入15g KNO3固体并充分溶解
D.将65g溶液的温度从t2℃降低到t1℃
相关试题

