【题目】(6分)溶解度是解决溶液相关问题的重要依据.
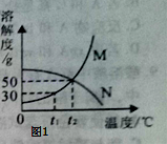
Ⅰ.根据图1解决下列问题:(M,N均不含结晶水)
(1)温度为 ℃时,M,N两种物质的溶解度相等;
(2)t1℃时,将20gM加入50g水中,充分溶解,形成溶液的质量为 g.保持温度不变,向该溶液中再加入10g水充分搅拌,溶液的溶质质量分数将 (填“变大”、“变小”或“不变”);
(3)t2℃时,将25gN加入50g水中,完全溶解后要提高该溶液的溶解质量分数,其操作方法是 .
Ⅱ.根据表格解决实际问题:
温度/℃ | 20 | 30 | 50 | 80 | 90 | |
溶解度/g | KNO3 | 31.6 | 45.8 | 85.5 | 100 | 169 |
K2CO3 | 110 | 114 | 121 | 126 | 139 |
某KNO3样品中含有少量K2CO3,其提纯过程如图2: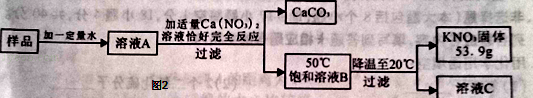
(1)图2中溶液C是 (填“饱和”或“不饱和”)溶液;
(2)样品中钾元素的质量为 g(结果保留整数).
参考答案:
【答案】Ⅰ、(1)t2 (2)65 不变 (3)降低温度,继续加入N物质
Ⅱ、(1)饱和 (2)33
【解析】
试题分析:Ⅰ、(1)根据溶解度曲线,温度为t2 ℃时,M,N两种物质的溶解度相等
(2)根据溶解度曲线,t1℃时,M的溶解度为30g,故将20gM加入50g水中,充分溶解,只能溶解15g,所以形成溶液的质量为50g+15g=65g;向该溶液中再加入10g水充分搅拌,所得溶液仍然是该温下的饱和溶液,故溶液的溶质质量分数将不变
(3)根据溶解度曲线,N的溶解度为50g,故t2℃时,将25gN加入50g水中,完全溶解后刚好饱和,故要提高该溶液的溶解质量分数,必须要增加溶液中溶质的质量,所以其操作方法是:降低温度,继续加入N物质
Ⅱ、(1)加适量Ca(NO3)2溶液发生的反应:K2CO3+Ca(NO3) 2==CaCO3↓+2KNO3,故50℃饱和溶液B,即为KNO3的饱和溶液,故图2中溶液C仍然是饱和溶液
(2)对比50℃、20℃时KNO3的溶解度,结合将50℃时的KNO3饱和溶液降温到20℃,降温过程中析出了53.9g KNO3,可判断原溶液中含有KNO3的质量为85.5g,再根据质量守恒定律:在反应中,元素的质量不变,而元素的质量=物质的质量×元素的质量分数,故样品中钾元素的质量=85.5g×39/101×100%=33g
-
科目: 来源: 题型:
查看答案和解析>>【题目】黄铁矿矿石的主要成分为二硫化亚铁(FeS2),取一块质量为30克的黄铁矿矿石样品在氧气中完全灼烧后得到10克氧化铁(其中的铁全来自二硫化亚铁)同时生成二氧化硫。
(1)二硫化亚铁中硫元素的化合价为
(2)计算黄铁矿矿石样品中二硫化亚铁的质量分数。
-
科目: 来源: 题型:
查看答案和解析>>【题目】把盛有5g 16%的NaOH溶液的短试管放入盛有10g 16%的CuSO4溶液的锥形瓶里,如图所示,倾斜锥形瓶直到使两溶液充分混合,混合后不可能的是( )
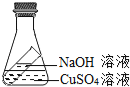
A. 产生蓝色沉淀0.98g
B. 锥形瓶内物质总质量不变
C. 所得溶液的Na2SO4质量分数大于9.5%
D. 所得的Na2SO4溶液质量与原CuSO4溶液质量相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】某地规定工业排放的废气中S02的含量不得超过0.4mg/L。某兴趣小组利用以下反应:S02+I2+2H20=H2S04+2HI,测定某工业废气中S02的含量,测试装置如图所示。
测试步骤:
①碘溶液的配制:准确称取l.27g碘单质,加入少量碘化钾,先溶解在100mL水中,继续加水配制成l000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液。
③把l00mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。
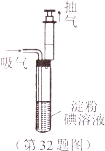
然后缓缓向外拉,使吸入试管内的废气与淀粉碘溶液充分接触。每次抽取的气体为l00mL,重复抽取n次,直到溶液的颜色变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)排放到空气中的S02气体主要来自于 燃烧。
(2)步骤②中,5mL溶液中溶有碘单质 mg,滴入淀粉试液后,溶液变为 色。
(3)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色。试计算该废气中S02含量,并判断是否符合排放标准。
-
科目: 来源: 题型:
查看答案和解析>>【题目】课外小科约老师继续探究铁粉和硫粉反应的实验:他们各自取一定量的铁粉和硫粉均匀混合后堆放在石棉网上,在其中插入烧红的玻璃棒,反应立即发生。拿掉玻璃棒后,反应继续剧烈进行,反应过程中有少量刺激性气味的气体x产生。反应结束后,都得到了黑色固体。老师得到的黑色固体不会被磁铁吸引,而小科的却会被磁铁吸引。
(1)铁和硫的反应是 (填“放热”或“吸热”)反应。
(2)气体x的化学式为 。
(3)对比老师的实验结果,小科猜想自己得到的黑色固体可能是有剩余的铁或有生成的四氧化三铁。小科想验证是否有铁剩余。
老师启发小科:硫化亚铁能与稀硫酸反应,产生硫化氢气体,该气体能被氢氧化钠溶液吸收。于是,小科认为正确连接如图所示的三个装置并进行实验,如果a处有水压出,就能验证有铁剩余。

①小科依次连接各装置的导管口:e→→b→a。(填“c→d”或“d→c”)
②老师指出设计不够合理,不能就此验正猜想。请你帮小科说出不够合理的原因: 。
于是小科改进了实验设计,继续进行探究…
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图示与对应的叙述相符的是
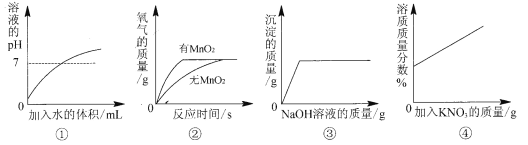
A.图①表示向稀盐酸中不断加水
B.图②表示探究过氧化氢制氧气的反应中二氧化锰的作用
C.图③表示向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液
D.图④表示20℃时,向一定量的接近饱和的硝酸钾溶液中加入硝酸钾固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】(8分)根据所学的知识并结合下列仪器,回答有关问题:
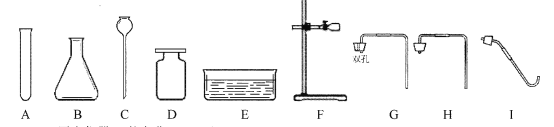
(1)写出仪器A的名称 。
(2)实验室以氯酸钾为原料制取并收集氧气,完成这个实验除选用A、D、E、F,I外,还需增加的仪器是 ,反应的化学方程式为 。
(3)实验室用石灰石和稀盐酸制取二氧化碳,组装一套气体发生装置所需的仪器是
(填字母),反应的化学方程式为
(4)通过查阅资料获知:镁在加热条件下与O2、N2、CO2、H2O均能发生反应;氮化镁(Mg3N2)能与水反应;碱石灰的主要成分是生石灰和氢氧化钠固体。小强欲在实验室里以空气和镁粉为原料制取少量氮化镁。可供选择的装置和药品如下图所示:
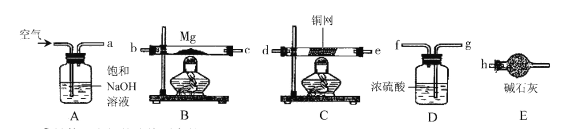
①导管口之间的连接顺序是:a→()()→()()→()()一h。
②通气后,应先点燃装置 (填“B”或“C”)的酒精灯,装置E的作用是
相关试题

