【题目】某炼铁厂对本厂购进的赤铁矿样品(主要成分是氧化铁)进行分析。取20g样品放入烧杯中,加入219g稀盐酸时恰好完全反应,过滤后所得溶液的质量为235g
(假设杂质既不溶于酸,也不溶于水;不考虑实验中溶液的质量损失)。
请计算:
(1)赤铁矿样品中铁元素的质量分数为 %。
(2)所用稀盐酸中溶质的质量分数。(结果精确到1%)
参考答案:
【答案】(1)56%;(2)10%
【解析】(1)由质量守恒定律知,赤铁矿样品中含氧化铁质量为20g-﹙20g+219g-235g﹚=16g. 赤铁矿样品中铁元素的质量分数为∶16g×![]() ×100%=11.2g.
×100%=11.2g.
![]() ×100%=56%;
×100%=56%;
(2)解∶设所用稀盐酸中溶质的质量为xg
Fe2O3 +6HCl=2FeCl3 +3H2O
160 219
16g x
![]() =
=![]() ,x=21.9g. 所用稀盐酸中溶质的质量分数∶
,x=21.9g. 所用稀盐酸中溶质的质量分数∶![]() ×100%=10%.
×100%=10%.
答∶(1)赤铁矿样品中铁元素的质量分数为56%;
(2)所用稀盐酸中溶质的质量分数是10%。
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液100g,需要20%的NaOH溶液
A.95 g B.10 g C.50 g D.100 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,铜制品生锈可生成绿色的铜绿。兴趣小组同学进行了下列相关探究。
探究一:甲组同学设计并进行实验,探究铜片生锈的必要条件。
【猜想】常温下,铜生锈可能与氧气、二氧化碳、水蒸气有关。
【实验】利用下图所示装置进行实验,并持续观察一个月。

他们观察到只有实验①中铜片表面生锈,实验②、③、④中铜片始终无明显变化。
【解释与结论】
(1)试管中的蒸馏水要预先煮沸,其目的是___________________________。
(2)实验④中氢氧化钠溶液的作用是____________________(用化学方程式表示)。
(3)得出“铜生锈一定与二氧化碳有关”的结论,依据的两个实验是________(填序号)。
(4)由上述实验推知,铜生锈的条件是与氧气、水蒸气、二氧化碳同时接触。
【反思与评价】
(5)在做猜想与假设时,同学们认为铜生锈与氮气无关,其理由是_________。
(6)欲进一步证明铜绿中含有碳酸盐,所需的试剂是________________。
探究二:乙组同学探究加热铜绿会生成什么物质。
他们与老师一起进行了下图所示的实验。实验过程中,观察到试管口有无色液体产生,澄清石灰水变浑浊。实验完成后,试管内固体由绿色变为黑色。
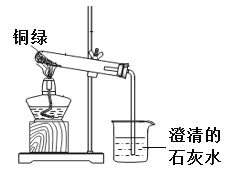
(7)他们经过讨论,猜想黑色固体可能是氧化铜或者是炭粉,或者是二者的混合物。乙组同学继续实验,取少量黑色固体于试管中,____________(填实验操作以及现象),证明只有氧化铜。写出该反应的化学方程式___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量增加 ④溶液的质量减轻.
A.②③ B.①②③ C.①②④ D.①②
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中不属于合金的是
A.生铁 B.钢 C.金刚石 D.黄铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】将下列各种溶液里溶质的化学式分别填在横线内.
氯化钠溶液 医用酒精溶液 稀硫酸 石灰水 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )
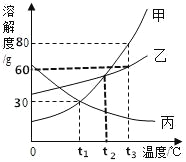
A.甲中混有少量杂质乙,可采用降温结晶的方法进行提纯
B.t3℃时,将甲、丙的饱和溶液降温,甲溶液溶质的质量分数减小,丙不变
C.t2℃时,甲、丙溶液中溶质的质量分数甲>丙
D.t1℃时,60g水中溶解18g甲可得到其饱和溶液
相关试题

