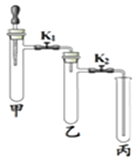
【题目】利用表中装置进行下列实验。
实验装置 | 实验1 | 实验2 |
| ①甲试管中放入少量MnO2,滴管中放入过氧化氢溶液,乙、丙中分别放入一小块白磷依次加入适量80℃的水,白磷均不燃烧 ②打开K1、K2,将过氧化氢溶液滴入试管,观察到乙试管中白磷不燃烧,丙中白磷燃烧 ③一段时间后,丙中导管内液 面上升 | ①关闭K1,打开K2,甲试管中充满CO2,滴管中放入浓NaOH溶液;乙试管中放入适量铁粉,丙中放入约半试管稀盐酸 ②将浓NaOH溶液滴入甲试管中,一段时间后,打开K1 ③一段时间后,观察乙、丙试管中的现象 |
(1)实验1:甲中发生反应的化学方程式是_______________,对比乙和丙中的实验现象,本实验欲探究的燃烧条件是_____________;步骤③中“丙中导管内液面上升”的原因是________________。
(2)实验2:甲中发生反应的化学方程式为____________;步骤③乙中的现象是_____________;丙试管中的现象是_________。
【答案】 2H2O2![]() 2H2O+O2↑ 可燃物燃烧需要与氧气接触 甲中反应放热,一段时间后温度降低,导致压强减小 CO2+2NaOH==Na2CO3+H2O 丙试管中稀盐酸被倒吸入乙试管,产生大量气泡,溶液由无色变为浅绿色 开始丙试管中稀盐酸被倒吸入,稍后有气泡产生
2H2O+O2↑ 可燃物燃烧需要与氧气接触 甲中反应放热,一段时间后温度降低,导致压强减小 CO2+2NaOH==Na2CO3+H2O 丙试管中稀盐酸被倒吸入乙试管,产生大量气泡,溶液由无色变为浅绿色 开始丙试管中稀盐酸被倒吸入,稍后有气泡产生
【解析】本题主要考查碱、酸的性质,燃烧条件的探究。解答时要根据各种物质的性质,气体压强的知识,结合各方面条件进行分析、判断,从而得出正确的结论。
(1)实验1:甲中过氧化氢在二氧化锰催化作用下分解生成水和氧气,发生反应的化学方程式为:2H2O2![]() 2H2O+O2↑;对比乙和丙中的实验现象,乙和丙中的温度都达到了白磷的着火点,乙没有与氧气接触,丙与氧气接触,乙中白磷不燃烧,丙中白磷燃烧,说明本实验欲探究的燃烧条件是与氧气接触;步骤③的现象说明装置内压强减小,压强减小的原因是装置甲中反应放热,一段时间后温度降低,导致压强减小;
2H2O+O2↑;对比乙和丙中的实验现象,乙和丙中的温度都达到了白磷的着火点,乙没有与氧气接触,丙与氧气接触,乙中白磷不燃烧,丙中白磷燃烧,说明本实验欲探究的燃烧条件是与氧气接触;步骤③的现象说明装置内压强减小,压强减小的原因是装置甲中反应放热,一段时间后温度降低,导致压强减小;
(2)实验2:甲中二氧化碳能和氢氧化钠反应生成碳酸钠和水,发生反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O;
(3)打开K1,乙中的现象是丙中的稀盐酸倒吸入乙中,铁和稀盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液是浅绿色溶液,因此有大量的气泡产生,溶液由无色变为浅绿色;乙试管中产生氢气压强增大,氢气会进入丙中。丙试管中出现的现象是开始丙试管中稀盐酸被倒吸入,稍后有气泡产生。