【题目】化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭。”他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3。
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
③Na2O是白色固体,与H2O反应生成NaOH。
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)

(1)实验记录
序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
① | 打开a,关闭b,由长颈漏斗注入浓盐酸 | A中产生大量气泡E中出现浑浊 | E中反应的化学方程式为_________ |
② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体G中产生黑色沉淀 | 反应产物一定有____和______ |
③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有___ |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的_____________。
②装置B中发生的反应的化学方程式是__________________,若无装置C,对实验有影响的物质是_________。
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,________________________。
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)____________
参考答案:
【答案】 CO2+Ca(OH)2===CaCO3↓+H2O C CO Na2CO3 排出装置中的空气,防止空气的干扰 NaHCO3+HCl=NaCl+H2O+CO2↑ 水 加入过量CaCl2溶液至不再产生沉淀,在上层清液中滴加酚酞试液,溶液呈红色.说明 色固体中含Na2O;若溶液不变色,则产物中没有Na2O。 25g
【解析】试题分析:(1)①氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
②内壁附着黑色固体,说明反应生成了碳;G中产生黑色沉淀,说明反应生成了一氧化碳
③取D中白色固体于试管中,加水溶解,再加入石灰水,产生白色沉淀,说明反应产物还有Na2CO3
(2) ①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是防止空气中的氧气和水对实验产生干扰;
②浓盐酸挥发氯化氢气体与碳酸氢钠反应NaHCO3+HCl=NaCl+H2O+CO2↑、C装置中浓硫酸干燥作用,故对实验有影响的物质是水。
③加入过量CaCl2溶液至不再产生沉淀,在上层清液中滴加酚酞试液,溶液呈红色.说明 色固体中含Na2O;若溶液不变色,则产物中没有Na2O。
(3)解:设需要石灰石的质量为X
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 44
X(1-20%) 8.8g
100/44=X(1-20%)/8.8g X=25g
-
科目: 来源: 题型:
查看答案和解析>>【题目】我们生活在不断变化的物质世界中,下列变化属于化学变化的是
A. 浓盐酸的挥发 B. 浓硫酸吸水 C. 生石灰吸水 D. 磁悬浮列车中液氮制冷
-
科目: 来源: 题型:
查看答案和解析>>【题目】日常生活中见到下列现象,其中发生了化学变化的是
A.冰融化成水 B.氢气球在烈日下爆裂
C.牛奶变酸了 D.铁矿石的粉碎
-
科目: 来源: 题型:
查看答案和解析>>【题目】有关NaOH与CO2反应的探究
探究一:检验NaOH固体样品露置空气中一段时间后的成分
【查阅资料】Na2CO3溶液是碱性;KCl、BaCl2溶液显中性、BaCO3难溶于水。
(1)检验样品是否变质。写出氢氧化钠变质的化学方程式________________。
(2)检验样品是否完全变质。实验操作:取样品加水溶解,先加过量的________(填编号,下同),再滴加________________。
A.盐酸 B.KCl溶液 C.BaCl2溶液 D.Ba(OH)2溶液 E.酚酞试液
探究二:用NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数
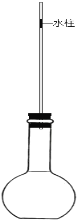
【实验装置】如图所示,向细玻璃管内注入少量水,形成一段水柱;经检查该装置气密性良好。已知细玻璃管单位长度的容积为0.1ml/cm。水柱 的质量忽略不计。
【操作步骤】保持外界条件不变,完成以下操作:
将40mL浓NaOH溶液迅速倒入烧瓶内,立即塞紧橡皮塞,并在细玻璃管上标记水柱底部的位置,测得该标记以下细玻璃管及烧瓶的总容积为340mL。实验中观察并测量得出水柱缓慢向下移动的距离为3.0cm。
(3)检查如图装置气密性的操作方法:___________________。
(4)仅根据本次测量数据,该气体样品中酸性气体的体积分数为______
(5)在上述操作步骤②中,若装置温度略有升高,实验结果______(填 “偏大”、“不变”或“偏小”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列所示分别是二氧化碳的制取、干燥、收集和性质检验的装置图,其中正确的是( )
A.
 B.
B.  C.
C.  D.
D. 
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学设计了以下三个实验,要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是( )
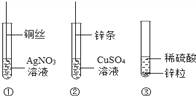
A. ①②
B. ②③
C. ①③
D. ①②③
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作符合安全要求的是( )
A.
 验证氢气的可燃性 B.
验证氢气的可燃性 B.  闻气体气味
闻气体气味C.
 移走蒸发皿 D.
移走蒸发皿 D.  稀释浓硫酸
稀释浓硫酸
相关试题

