【题目】某学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。取100g废水于烧杯中,加入100gBaCl2溶液,恰好完全反应,经过滤得到176.7g溶液。(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)
(1)充分反应后生成沉淀的质量为_______g;
(2)该工业废水中硫酸的质量分数为__________?(写出计算过程,计算结果精确到0.1%)
参考答案:
【答案】 23.3g 9.8%
【解析】(1)根据质量守恒定律知,充分反应后生成沉淀的质量为100g+100g-176.7g=23.3g。(2)解∶设该工业废水中硫酸的质量分数为x
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
100g×x 23.3g
![]() =
=![]() , x=9.8%。
, x=9.8%。
答∶(1)充分反应后生成沉淀的质量为23.3g。(2)该工业废水中硫酸的质量分数为9.8%。
点睛∶∶灵活应用质量守恒定律,正确书写化学方程式是顺利完成本题的重要保证。
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按如图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_________,检验B中气体的现象是___________。
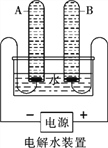
②微观该反应中发生分解的微粒名称是___________。
③结论:水由__________组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_________。
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
②下列实验中,对水的主要作用分析不全面的是_________(填字母)
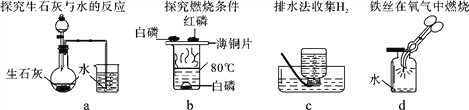
A.a图中的水便于观察烧瓶内气压变化
B.b图中的水提供热量
C.c图集气瓶中的水排尽空气且便于观察H2何时集满
D.d图中的水防止熔融物炸裂集气瓶
-
科目: 来源: 题型:
查看答案和解析>>【题目】NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如下图所示。
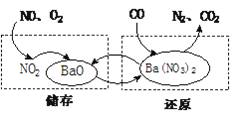
(1)还原时还原尾气可以是CO、H2等,存在如下反应:5CO + Ba(NO3)2 == N2 + X + 5CO2
①反应中,碳元素的化合价_______(填“升高”或“降低”)。
②X的化学式是______。
(2)储存时,部分NO发生反应的化学方程式为___________;吸收NOx(如NO、NO2)的物质是_____________。
(3)NO气体通过NSR技术转化为N2的总反应方程式是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下列短文,并回答问题。
农药是一把“双刃剑”,在为人类带来益处的同时,有的农药也会给人类带来一些负面影响。为了趋利避害,世界上绝大多数国家都对农药实行了严格的管理,普遍建立了农药登记和淘汰退出制度,以最大限度发挥好农药对农业生产的保障作用和防范农药的使用风险。农药在投放市场前,必须申请农药登记。申请登记的农药产品,只有经农药登记部门科学评价,证明其具有预期的效果,对人畜健康或环境无不可接受的风险后,方可取得登记,并在规定的范围内销售、使用;已使用的农药,经风险监测和再评价,发现使用风险增大时,由农药登记部门作出禁用或限用规定。20世纪80年代,我国对六六六、滴滴涕等高残留有机氯农药做出了停产和停用的决定,90年代,禁止生产和使用杀虫脒、除草醚等农药。
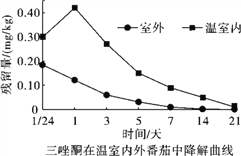
合理使用农药,可以达到农药使用的利弊平衡,例如有科研人员测定了三唑酮在温室大棚内和室外番茄中降解规律如右下曲线。
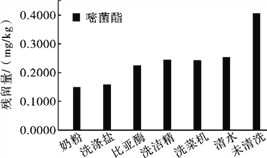
去皮和烹饪可以去除果蔬中部分农药残留,蒸煮炒均能有效降低黄瓜中的农药残留量,但部分果蔬不适用去皮和烹饪,如橄榄、草莓、樱桃等,因此清洗成为了消费者去除农药残留的方式。由于大多数农药难溶于水,一般在水中加入食盐、面粉、NaHCO3、醋酸等用于提高农药残留的去除效果,也有人研究了利用奶粉等6种方法去除黄瓜中农药残留效果,如下图所示。
请回答下列问题:
(1)下列说法正确的是_________。
A.必须全面禁止使用农药,杜绝农药对人和环境的污染
B.合理规范使用农药,既能提高作物产量又能将农药危害降低到合理范围
C.滴滴涕、除草醚已经禁止使用
(2)奶粉、洗涤盐、比亚酶、洗洁精、清水、洗菜机中除去黄瓜中农药残留效果最好的是_____。
(3)温室大棚内种植番茄施用三唑酮后,番茄中残留量最大的是______天,原因是_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B. 10 mL C. 50 mL D. 100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
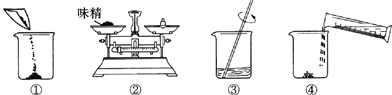
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
-
科目: 来源: 题型:
查看答案和解析>>【题目】(题文)国际上有铟等7种元素的相对原子质量采用了我国科学家张青莲测的数据。由如图可知铟元素

A. 是非金属元素
B. 质子数为49
C. 相对原子质量是114.8克
D. 与其他元素根本区别是中子数不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲
乙
丙
丁
戊
A
铁
硝酸银
碳酸钙
氢氧化钡
稀盐酸
B
硝酸银
铁
稀盐酸
氢氧化钡
碳酸钙
C
硝酸银
铁
碳酸钙
氢氧化钡
稀盐酸
D
铁
氢氧化钡
碳酸钙
硝酸银
稀盐酸
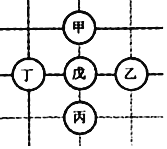
A. A B. B C. C D. D
相关试题

