【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究氯酸钾和二氧化锰的质量比对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
猜想Ⅰ:除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
【设计实验】
按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
【数据和结论】
(1)由实验__________与实验④对比,证明猜想合理;(2)实验所用的三种物质中,催化效果最好的是_________。
【反思】
若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的_______和_________是否改变。小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应可制取氧气。
【分析与反思】
(1)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气你认为猜想_______(填序号)一定是错误的,理由是____________________________,
(2)过氧化钙与水反应虽然没有快速收集到大量氧气,但过氧化钙在水中持续、缓慢放出氧气,因此小林认为渔民用过氧化钙做增氧剂。写出此反应的符号表达式______________________。
(3)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_________________。
【计算】该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

(1)过氧化钙中氧元素的化合价___________________;
(2)过氧化钙中钙元素与氧元素的质量比为_______;
(3)100g过氧化钙中钙元素质量为______________;
(4)该产品中过氧化钙的质量分数至少为_______。
参考答案:
【答案】 ① 二氧化锰 质量 化学性质 ② 反应前后元素种类不变 略 加热过氧化钙和水的混合物(或向过氧化钙和水的混合物中加入催化剂) -1 5:4 55.6g 72%
【解析】探究氯酸钾和二氧化锰的质量比对反应速率的影响。误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气。猜想Ⅰ:除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。【设计实验】【数据和结论】(1)由实验①与实验④对比,证明猜想合理;(2)实验所用的三种物质中,催化效果最好的是二氧化锰,所需温度最低。【反思】
若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的质量和化学性质是否改变。联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。猜想Ⅱ:过氧化钙与水反应可制取氧气。实验结论:过氧化钙与水反应可制取氧气。【分析与反思】(1) 过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。猜想②一定是错误的,理由是反应前后元素种类不变。(2) 过氧化钙在水中持续、缓慢放出氧气,此反应的符号表达式∶CaO2 +H2O→Ca﹙OH﹚2 +O2↑。(3) 对此实验进行改进,使该反应加快,合理化建议∶①加热过氧化钙和水的混合物②向过氧化钙和水的混合物中加入催化剂。【计算】试计算:(1)过氧化钙中氧元素的化合价∶﹙+2﹚+2x=0,x=-1价;(2)过氧化钙中钙元素与氧元素的质量比为∶40∶16×2=5:4;(3)100g过氧化钙中钙元素质量为∶100g×![]() ×100%=55.6g;(4)该产品中过氧化钙的质量分数至少为∶Ca至少为40%,CaO2 相对房子质量是72,过氧化钙的质量分数至少为72%。
×100%=55.6g;(4)该产品中过氧化钙的质量分数至少为∶Ca至少为40%,CaO2 相对房子质量是72,过氧化钙的质量分数至少为72%。
点睛∶这是一道综合题,二氧化锰是氯酸钾受热分解的催化剂,但不是唯一的催化剂。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了证明长期暴露在空气中的氢氧化钠浓溶液已变质,某同学先取2mI试样于 试管中,而后进行如下实验,其中不能达到目的的是 ( )
A. 加入足量盐酸, 观察现象 B. 加入澄清石灰水,观察现象
C. 加入氯化钡溶液,观察现象 D. 通适量CO2气体,观察现象
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列应用与中和反应原理无关的是( )
A. 用熟石灰改良酸性土壤
B. 用浓硫酸干燥湿润的氧气
C. 用肥皂水涂在被蚊虫叮咬的皮肤上止痒
D. 用氢氧化钠溶液洗涤石油产品中的残留硫酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于酸的说法错误的是( )
A. 浓硫酸具有吸水性,浓盐酸具有挥发性
B. 稀盐酸和稀硫酸都可用于金属除锈
C. 稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D. 稀硫酸能够与活泼金属反应制取氢气
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的一些装置,据图回答有关问题。
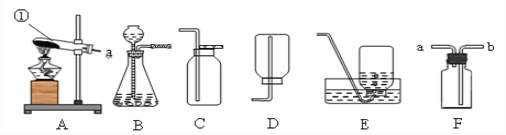
(1)写出指定仪器的名称:①_______。
(2)实验室用双氧水和二氧化锰制取较纯净的氧气装置组合是____,符号表达式为_____________,
(3)写出实验室用高锰酸钾制取氧气的符号表达式是____________________,如果用A作为发生装置,则需改进的是__________________;当选用E装置收集完气体后,测得其纯度明显偏低,原因可能是_______(填序号)
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.未见气泡连续均匀冒出时就开始收集
(4)硫化氢(H2S)气体是一种无色有臭鸡蛋气味的气体,密度比空气大,易溶于水,实验室中可以用固体硫化亚铁(FeS)和稀硫酸在常温下反应制取,实验室制取硫化氢气体选用的发生装置为_______(填字母编号);如果用F图所示装置收集硫化氢气体,气体应从______(填“a”或“b”)端管口通入。
(5)在2017年江苏省中学化学创新实验调演中,李彬老师设计了“氢氧焰”的实验,装置如下图所示:
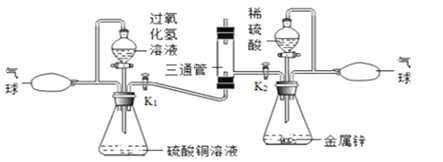
利用氢气与氧气的发生装置制取并储存纯净的气体于气球中。A瓶中硫酸铜溶液的作用是_________,B瓶中产生氢气,通过玻璃活塞K1、K2分别有序控制氧气和氢气的流量,先后进行如下操作:①关闭K2,打开K1,通入氧气,将带火星的木条置于三通管口处,观察到___________,说明氧气具有助燃性。将燃着的木条移开,管口处无火焰。
②关闭K1,打开K2,通入氢气,将燃着的木条置于三通管口处,管口处有火焰。移去燃着的木条,氢气安静地燃烧,说明氢气具有可燃性。把铁片放在火焰上一段时间,铁片呈红热状。打开K1,通入氧气,铁片迅速熔断被切割,由此得出的结沦是_______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组溶液,不用其他试剂就能鉴别出来的是( )
A. 稀H2SO4、KOH、CuSO4、MgC12
B. Na2SO4、Ba(NO3)2、KNO3、NaCl
C. BaCl2、稀HC1、Na2CO3、AgNO3
D. NaNO3、AgNO3、KC1、CaC12
-
科目: 来源: 题型:
查看答案和解析>>【题目】30℃时将等质量的两份饱和石灰水,一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃.则两种情况下均不改变的是( )
A. 溶剂的质量 B. 溶质的质量
C. 溶质的溶解度 D. 溶液中溶质的质量分数
相关试题