【题目】下图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。试根据题目要求,回答下列问题:
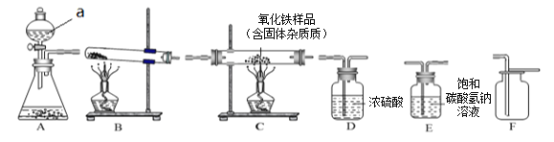
(1)若以石灰石和稀盐酸为原料制取二氧化碳,因盐酸会挥发出少量的氯化氢气体,导致制取的气体不纯,可用饱和碳酸氢钠溶液吸收。现要制备、收集一瓶干燥的、不含氯化氢的二氧化碳气体。
①所选仪器的连接顺序为__________________________(填写仪器序号字母)
②仪器a的名称是_________________
③生成二氧化碳时,A中所发生反应的化学方程式为______________________________
④将少量的CO2气体通入盛有大量澄清Ca(OH)2溶液的大烧杯中,烧杯中溶液的质量与之前相比会__________ (填“增大”“减小”“不变”之一)。
(2)小强同学欲用一氧化碳气体测定某不纯氧化铁样品的纯度(杂质不参与任何反应),小强同学取2.5g氧化铁样品设计了实验方案:气体流向是从左向右,选择的仪器按“一氧化碳气体→C→尾气处理装置”顺序连接,然后进行实验(假设有关反应均反应完全)。若其他操作正确,反应结束后测得C装置减少了0.48g(不考虑空气中成分对装置质量的影响),则此氧化铁样品中氧化铁的质量分数为______________。
参考答案:
【答案】A-E-D-F 分液漏斗 CaCO3+2HC1=CaCl2+H2O+CO2↑ 减小 64%
【解析】
本题考查了气体的制取装置、收集装置和洗气装置的选择,同时也考查了化学方程式的书写和有关的计算,综合性比较强。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。
(1)①实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,不需要加热,发生装置选A,要收集一瓶干燥、纯净的二氧化碳气体,要把杂质氯化氢气体和水蒸气除去,氯化氢气体与和碳酸氢钠溶液反应生成氯化钠、水和二氧化碳,可以除去氯化氢气体,水蒸气用浓硫酸除去,除去水蒸气放在最后,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集。所以所选仪器的连接顺序为A-E-D-F;
②仪器a的名称是分液漏斗;
③生成二氧化碳时,A中所发生反应的化学方程式为CaCO3+2HC1=CaCl2+H2O+CO2↑;
④将二氧化碳通入澄清石灰水中,二氧化碳和氢氧化钙反应生成了碳酸钙沉淀,溶液中的溶质减少,溶液的质量减小;
(2)设氧化铁的质量为x,玻璃管内减小的质量就是氧元素的质量,所以
Fe2 O3 +3CO![]() 2Fe+3CO2 固体减小质量
2Fe+3CO2 固体减小质量
160 48
X 0.48g
![]() x=1.6g
x=1.6g
氧化铁样品中氧化铁的质量分数=![]() ×100%=64%。
×100%=64%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将7.3%的稀盐酸滴入10g氢氧化钠溶液(滴有2滴酚酞溶液)的烧杯中,恰好完全反应时消耗此稀盐酸的质量为5g。回答并计算:
(1)恰好完全反应时的现象为_______________
(2)求此NaOH溶液中溶质的质量为_____________。
(3)求所得溶液中溶质的质量分数为_____________(酚酞溶液质量不计)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是一门以实验为基础的自然学科。下列实验操作中,正确的是
A.
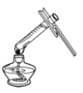 加热液体 B.
加热液体 B. 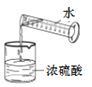 稀释浓硫酸 C.
稀释浓硫酸 C. 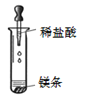 滴加稀盐酸 D.
滴加稀盐酸 D.  过滤
过滤 -
科目: 来源: 题型:
查看答案和解析>>【题目】工业上采用氨碱法生产纯碱(Na2CO3),主要流程如图1:
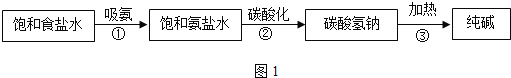
(1)在①③三个过程中,发生分解反应的是____________(填序号)
(2)侯氏制碱法以食盐为主要原料制取纯碱,制得的纯碱中常含有少量氯化钠。Na2CO3和NaCl的溶解度曲线如图2所示,试回答下列问题:
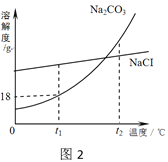
①在t1℃时,Na2CO3的溶解度是____g
②t2℃时,NaCl的溶解度_______Na2CO3的溶解度(填“大于”“等于”“小于”之一)
③要从海水中提取NaCl,应采用的方法是_________________(填“蒸发结晶”或“降温结晶”)
④若把10g的Na2CO3加入50g水中,充分溶解后,得到t1℃的Na2CO3溶液的质量是___g
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一固体混合物A,已知其中可能含有MgCl2、CuSO4、CaCO3、FeCl3四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(假设过程中所有发生的反应都恰好完全进行)。
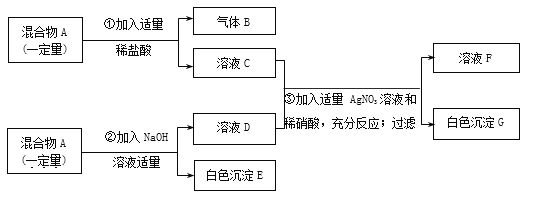
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为________________
(2)在混合物A里,上述四物质中肯定不存在的物质是______________________(写化学式)
(3)在溶液F中,主要含有_________种溶质,其中大量含有的酸根离子符号是_____________
(4)写出1个生成白色沉淀G的化学方程式:_________________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学小组的同学对金属元素及金属材料进行系列研究。
(1)“越王勾践剑”埋藏在地下两千多年,出土时依然光彩夺目、锋利无比,几乎没有丝毫锈蚀。下列选项中,与其保存完好的原因无关的是___________________(填序号)
A.埋藏环境中的氧气少 B.剑身曾经过防锈表面处理
C.材料(青铜)本身不容易生锈 D.埋藏环境的压强比较恒定
(2)我们的祖先很早就掌握了用孔雀石(主要成分是Cu2(OH)2CO3)和木炭一起加热进行火法炼铜的工艺。有关化学反应是:① Cu2(OH)2CO3
 2CuO+ CO2↑+ H2O②2CuO+ C
2CuO+ CO2↑+ H2O②2CuO+ C 2Cu + CO2↑。上述反应②属于________________类型。(选填“置换反应”、“复分解反应”之一)
2Cu + CO2↑。上述反应②属于________________类型。(选填“置换反应”、“复分解反应”之一)(3)碱式碳酸铜(化学式是Cu2(OH)2CO3)是一种不溶于水的固体粉末,取一定量该固体,放入干净的烧杯中,逐渐滴入溶质质量分数为10%的稀硫酸,滴入该稀硫酸的质量和反应产生气体的质量关系曲线如图所示。
(已知:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O)
请回答下列问题:

①当滴入上述稀硫酸至图中A点时,烧杯内溶液中大量存在的溶质为________________(填写化学式)
②当滴入上述稀硫酸至图中B点时,试通过计算,求此时所得不饱和溶液中溶质的质量______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)橘子是我们常吃的一种水果。剥开橘皮,会闻到橘子香甜的气味,说明粒子具有的性质_________;橘子中含有人体所需的营养素有__________(填写一种);橘子中含一种化学式为C6H8O6的物质,该物质中碳、氢、氧的质量比_________;橘子中钙元素是骨骼与牙齿的主要成分。钙元素的部分信息如下图,则下列说法中正确的是___________。

A、钙原子中的核外电子数为20
B、一个钙原子中有40个中子
C、钙离子核外电子层数为四
D、钙离子带两个单位正电荷
(2)碳酸氢钠、氧气是我们身边常见的物质,有着广泛的用途。
①氧气常用于气焊、供呼吸、助燃等,是因为氧气具有________________的性质。
②碳酸氢钠是发酵粉的成分之一,其俗称是___________,碳酸氢钠用于治疗胃酸过多症,其原因是______(用化学方程式表示)
(3)近日国产某品牌压力IH电饭煲,在硬件性能上打破了日本电饭煲在高端市场的垄断,使国人爱上中国造。如图为该品牌电饭煲实物图,请回答下列问题:

所标物质中,属于有机合成材料的是______(填一种序号即可);塑料防堵罩应使用_______(填“热塑性”或“热固性”)较好的塑料。
相关试题

