【题目】为测定某铁合金样品(除铁外,其余成分不溶于水,且不参与任何反应)中单质铁的含量,小冰同学进行实验如下:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为_____;
(2)样品中单质铁的质量分数为_____;
(3)根据已知条件列出求解加入的稀硫酸中溶质质量(x)的比例式为_____;
(4)最终所得到的不饱和溶液中溶质的质量分数为_____;
(5)若用含氧化铁80%的赤铁矿炼出上述实验中所需要的铁合金160t,则理论上需要赤铁矿的质量为_____.
参考答案:
【答案】 Fe+H2SO4═FeSO4+H2↑ 70% ![]() =
=![]() 10.1% 200t
10.1% 200t
【解析】本题考查了根据化学方程式和化学式的计算。分析实验过程中数据的含义是解题的关键。
(1)铁能够与硫酸反应生成硫酸亚铁和氢气,方程式为Fe+H2SO4═FeSO4+H2↑;
(2)样品中单质铁的质量分数=![]() =70%;
=70%;
铁的质量=8g﹣2.4g=5.6g
设稀硫酸中溶质的质量是x,生成硫酸亚铁的质量为y.
Fe+H2SO4═FeSO4+H2↑;
56 98 152
5.6g x y
![]() =
=![]()
x=9.8g
![]() =
=![]()
y=15.2g
(3)根据已知条件列出求解加入的稀硫酸中溶质质量(x)的比例式为:![]() =
=![]()
(4)溶液中水的质量为100g﹣9.8g+44.6g=134.8g,故溶液的溶质质量分数为![]() ×100%=10.1%;
×100%=10.1%;
(5)设需要铁矿石的质量是z
z×80%×![]() =160t×70%
=160t×70%
z=200t
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是关于氧气和二氧化碳实验室制取的实验,请回答下列问题:
(1)①A仪器的名称是_____;
②将实验室高锰酸钾制取氧气的装置图补充完整.
③确定该实验选择如图所示的发生装置,主要是考虑反应物的状态和_____这两个因素.
(2)①实验室用石灰石和稀盐酸制取二氧化碳时,发生反应的化学方程式为_____;
②为验证二氧化碳已经集满,要将_____放_____(均填字母).
a.带火星的木条 b.燃着的木条 c.集气瓶内 d.集气瓶口
(3)停止加热时,应先将导管移出水面,后熄灭酒精灯,否则停止加热后试管内①_____
_____,且不再产生气体,从而使试管内气体量减少,气压②_____(选填“变大”或“变小”),可能会使水槽中的水倒吸入试管,使试管因骤然冷却而炸裂.

-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年的中秋节虽然已经过去,但全家团聚的温馨时刻在我们的心中长存!
(1)中秋节的晚餐一定是一场视觉和味觉的双重盛宴,除享受美食外,有些同学也喜欢喝一些汽水,喝了汽水之后会打嗝,是因为汽水进入体内温度①_____,使其中溶解的②_____(填名称)气体溶解度③_____(选填“增大”或“减小”).
(2)饭后,人们用洗涤剂洗刷碗筷,利用的是洗涤剂对油污的_____作用.
(3)每逢中秋节,人们都要吃月饼.细心的同学会发现,袋装的月饼内部会有一小包黑色粉末,该粉末俗名为“双吸剂”,失效后会部分变成红褐色.
据此推测:“双吸”指的是吸收①_____和水蒸气,黑色粉末中可能含有的一种金属单质是②_____.

-
科目: 来源: 题型:
查看答案和解析>>【题目】勇往直前学习小组的同学们来到实验室,取来三瓶没有标签的溶液,标记为1、2、3号,已知它们分别是硫酸锌、硫酸铜、硝酸银溶液中的一种,为确定三种溶液的溶质,展开了探究:

【提出问题】三瓶溶液中的溶质分别是什么?
经过观察发现只有3号溶液为蓝色,而1、2号溶液均为无色.由此可知3号溶液中的溶质为(1)_____(填化学式);
【实验探究】
小冰的实验:
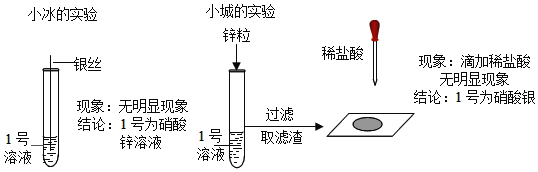
【评价交流】请你对小冰的实验设计及得出的结论做出评价(2)_____;小城的实验中,加入锌粒之后发生反应的化学方程式为(3)_____;过滤后所得到的滤液中一定含有的溶质是(4)_____(填化学式)
【归纳总结】此实验利用了金属可以与(5)_____反应的性质;可以判断金属能否在溶液中发生置换反应依据的是(6)_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭),下列说法不正确的是( )
A. 倭铅是指金属锌和铅的混合物
B. 煤炭中起作用的主要成分是C
C. 冶炼Zn的反应方程式为:ZnCO3+2C
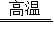 Zn+3CO↑
Zn+3CO↑D. 冶炼过程中有还原反应发生
-
科目: 来源: 题型:
查看答案和解析>>【题目】鸡蛋壳的主要成分是碳酸钙,某同学为了测定鸡蛋壳中碳酸钙的质量分数,设计了如图实验并进行计算,将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假定其他杂质不与盐酸反应),测得相关数据如图所示:
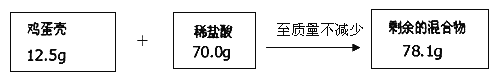
【数据处理】
(1)二氧化碳的质量_____.
(2)计算鸡蛋壳中碳酸钙的质量分数为_______,并写出计算过程.
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图1是实验室中的部分装置
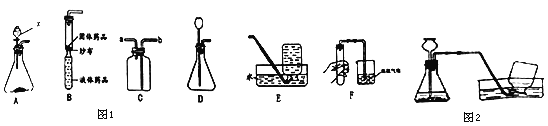
(1)仪器x的名称是_____.
(2)装置B是用软塑料管自制的气体发生装置,若利用锌和稀硫酸反应制取氢气,药品加入完毕后,接下来的操作是_____.
(3)用D装置制取气体时,固体应在液体之_____(填“前”或“后”)加入,某同学选用装置D和E来制取氧气,请写出该方法制氧气的化学方程式_____,在实验过程中,该同学动作太慢,还差少量的氧气收集满,锥形瓶中的反应就已经停止了(如图2所示),若想集满这瓶氧气,在不拆卸装置和不添加过氧化氢溶液的前提下,请你帮他想出一种解决方法:_____.
(4)用装置C收集CO2,验满时将燃着的木条的木条放在_____(填“a”或“b”)处.
(5)用分子的观点解释F操作的现象是_____.
相关试题

