【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案:
该方案的实验目的是:探究____________________对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
【猜想Ⅰ】除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
【设计实验】
按下表进行实验,并测定开始产生气体时的温度(即分解温度,分解温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
【数据和结论】
(1)由实验_________与实验④对比,证明猜想理;
(2)实验所用的三种物质中,催化效果最好的是_____________________。
【反思】
小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。
【猜想Ⅱ】过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②在试管中加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应_______(填“能”或“不能”)用于实验室制取氧气。
【分析与反思】
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是_____________________________。
(2)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想_______(填序号)一定是错误的,理由是______________________________。
(3)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_______。
【计算】该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

(1)过氧化钙的相对分子质量为_________________;
(2)该产品(右图)中过氧化钙的质量至少为___。
参考答案:
【答案】 氯酸钾、二氧化锰的质量比 ① 二氧化锰 不能 过氧化钙和水反应能持续、缓慢放出氧气 ② 化学反应前后元素种类保持不变,反应前没有碳元素 对试管里的液体加热或加催化剂等 72 72克
【解析】根据实验数据可知,该方案的实验目的是:探究氯酸钾和二氧化锰的质量比对反应速率的影响;【数据和结论】(1)加入氧化铁后氯酸钾分解产生氧气的温度比只加热氯酸钾时产生氧气的温度低很多;(2)分解温度最低的催化效果最好;【猜想Ⅱ】过氧化钙与水反应生成氧气的速率太慢,所以不能用于实验室制取氧气;【分析与反思】(1)根据实验现象,过氧化钙在水中反应的速度慢,持续的时间长,所以用过氧化钙做增氧剂的主要原因是:过氧化钙在水中持续、缓慢放出氧气;(2)根据质量守恒定律,化学反应前后元素的种类不变,反应物为过氧化钙和水,②的观点认为生成物是碳酸钙和氧气,这样反应物中不含有碳元素,而生成物中含碳元素,不遵循质量守恒定律,所以错误;(3)根据过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,由此可知加热过氧化钙和水的混合物有可能会使反应加快,因此实验的改进方法有加热过氧化钙和水的混合物(或向过氧化钙和水的混合物中加入催化剂);【计算】(1)过氧化钙的相对分子质量=40+16×2=72;(2) 该产品(右图)中过氧化钙的质量至少=![]() =72g。
=72g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用高锰酸钾制取氧气,有下列操作步骤:①加热,②检查装置的气密性,③装药品,固定装置到铁架台,④用排水集气法收集氧气,⑤从水槽中取出导管,⑥熄灭酒精灯,⑦连接仪器。其操作顺序正确的是
A. ②③⑦①④⑤⑥ B. ①⑦③②⑤④⑥
C. ⑦②③①④⑤⑥ D. ⑦③①②④⑥⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】日常生活中的下列变化,属于化学变化的是( )
A.酒精挥发 B.灯泡通电发光 C.铁生锈 D.自行车胎爆炸
-
科目: 来源: 题型:
查看答案和解析>>【题目】溴元素的原子结构示意图及其在周期表中的信息如下图所示.下列关于该元素说法错误的是( )

A. 该元素为非金属元素 B. n=5
C. 形成的离子是:Br- D. 原子序数为35
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验现象的描述正确的是
A. 木炭在氧气中燃烧、发出白光,生成二氧化碳
B. 硫在空气中燃烧,发出明亮的蓝紫色火焰
C. 红磷在空气中燃烧,产生大量白烟
D. 铁在空气中剧烈燃烧、火星四射,生成黑色固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过一段时间的化学学习,我们初步了解了实验室制取气体的知识。请结合图示回答问题:

(1)写出指定仪器的名称: ①___________;
(2)写出用高锰酸钾固体制取氧气的符号表达式__________________________;该反应属于_________(填基本反应类型)反应;如果利用该反应制取较干燥的氧气,收集装置应选__________(填序号);该装置中试管口略向下倾斜的原因是__________ 。上图中G是一种可用于集气、洗气等的多功能装置。若将G装置内装满水来收集氧气,则气体应从___________(填“b”或“c”)进入G中;
(3)实验室用装置B 制取氧气,写出该反应的符号表达式_________________________,如选用装置C代替装置B来制取氧气,你认为具有的优点是_______________________。
(4)在用KClO3加热制O2的过程中,发现产生O2的反应速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是________________________。
(5)某实验小组同学对双氧水制氧气的若干问题进行探究。

①利用图甲中A、B仪器可以组装一套测量氧气体积的装置,该装置导管的连接顺序是______(填导管接口编号)接C。
②A瓶中原有的空气对氧气体积测定______(填“有”或“没有”)影响?
 右图乙装置也可以用来测量反应中生成的氧气体积。为了较准确的测量氧气体积,在读取量气管中液面读数时,如量气管中液面低于水准管,应将水准管______(填“上移”,“下移”“不动”),直到两边液面相平。
右图乙装置也可以用来测量反应中生成的氧气体积。为了较准确的测量氧气体积,在读取量气管中液面读数时,如量气管中液面低于水准管,应将水准管______(填“上移”,“下移”“不动”),直到两边液面相平。 -
科目: 来源: 题型:
查看答案和解析>>【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
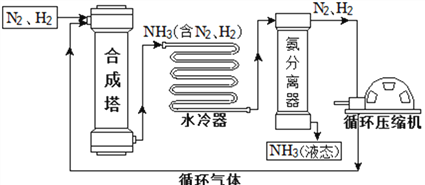
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的符号表达式是:__________________________________________________。
(2)生产过程中可重复使用的物质是_______________(填化学式)。
(3)根据表中的数据回答问题。
物质
H2
N2
O2
NH3
沸点/℃(1.01×105 Pa)
–252
–195.8
–183
–33.35
在1.01×105 Pa时,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在______℃。
(4)下图是合成塔中发生反应的微观粒子示意图:
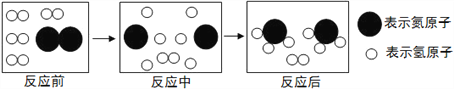
由图可知两种反应物N2与H2的分子个数比为____;该反应中的最小粒子是_________(填写化学符号)。
相关试题


