【题目】通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
20℃时,一些物质的溶解度 | ||
OH﹣ | CO32﹣ | |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
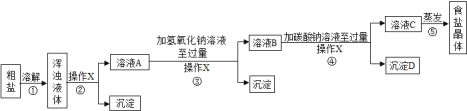
[交流与表达]
(1)实验操作X的名称是__,该操作中要用到的玻璃仪器有烧杯、玻璃棒和__.
(2)实验步骤③的主要目的是__ (用化学方程式回答);
(3)实验步骤④中生成的沉淀D是__.
[反思与评价]
(4)有同学认为原实验方案不完善,为了完善原实验方案,你设计的实验是_______。(写出补充部分的实验操作和现象)
【答案】过滤 漏斗 MgC12+2NaOH=2NaCl+Mg(OH)2↓ CaCO3 第五步蒸发前先向溶液中加稀盐酸至PH=7
【解析】
(1)操作X是固液分离的步骤,故是过滤。过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗。
(2)原溶液中的氯化镁可以与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,故该步骤的目的除去氯化镁,反应的方程式为:MgC12+2NaOH=2NaCl+Mg(OH)2↓。
(3)步骤4是氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,故填碳酸钙。
(4)由题干分析可知,溶液C中含有的溶质有碳酸钠和氯化钠,故要加入稀盐酸除去碳酸钠。

