【题目】碳还原氧化铜的实验装置如图甲、乙所示。甲图中酒精灯上网罩的作用是___。
(提出问题)碳燃烧时可能生成CO2也可能生成CO2,那么碳与氧化铜反应生成的气体是否也有多种可能?
(作出猜想)猜想I:CO;
猜想Ⅱ:CO2;
猜想Ⅲ:___。
(设计方案)实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。
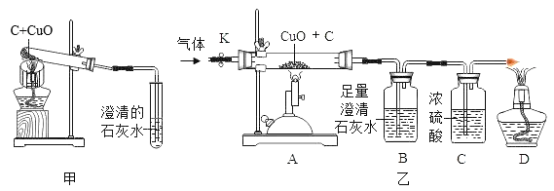
方案一:从定性观察角度判断
(1)实验时装置A处的现象是_____。
(2)若B中无明显现象,D处的气体能点燃,则猜想___(填序号)成立。
方案二:从定量计算角度判断:取一定量碳粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B+C(广口瓶+混合液) | m3 | m4 |
(3)若猜想Ⅱ成立,则理论上(m4-m3)__(m1-m2)(填“>”“<”或“=”)。
(4)若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的碳粉的质量m的取值范围是____。
(交流反思)实验开始前缓缓通入氮气的目的是_______。
【答案】集中火焰,提高温度 CO和CO2 黑色粉末变为(光亮的)红色 Ⅰ = 0.3g<m<0.6g 排尽装置内的空气,防止加热时发生爆炸,防止空气中的成分干扰实验
【解析】
酒精灯上的网罩可以集中火焰、提高温度;
作出猜想:碳与氧化铜在高温下反应生成二氧化碳,如果碳过量,碳会与二氧化碳在高温的条件下反应生成一氧化碳,故碳与氧化铜反应生成的气体可能是一氧化碳,还可能是二氧化碳,还可能是一氧化碳和二氧化碳的混合物,故猜想Ⅲ:CO和CO2
设计方案:方案一:(1)碳与氧化铜在高温的条件下反应生成铜和二氧化碳,碳和氧化铜是黑色的,铜是红色的,故实验时装置A处的现象是黑色粉末变为(光亮的)红色;
(2)二氧化碳能使澄清石灰水变浑浊,若B中无明显现象,说明无二氧化碳生成,一氧化碳具有可燃性,D处的气体能点燃,说明生成了一氧化碳,故猜想Ⅰ成立;
方案二:(3)若猜想Ⅱ成立,说明反应生成的气体是二氧化碳,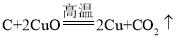 ,玻璃管中,反应前后,减少的质量,就是反应生成的二氧化碳的质量,二氧化碳能被澄清石灰水吸收,m4-m3即吸收的二氧化碳的质量,即碳与氧化铜在高温下反应生成二氧化碳的质量,故理论上(m4-m3)=(m1-m2);
,玻璃管中,反应前后,减少的质量,就是反应生成的二氧化碳的质量,二氧化碳能被澄清石灰水吸收,m4-m3即吸收的二氧化碳的质量,即碳与氧化铜在高温下反应生成二氧化碳的质量,故理论上(m4-m3)=(m1-m2);
(4)假设4g氧化铜与碳反应生成的气体全部是二氧化碳,则这时消耗碳的质量为x
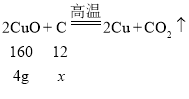
![]() x= 0.3g
x= 0.3g
假设4g氧化铜与碳反应生成的气体全部是一氧化碳,则这时消耗碳的质量为y
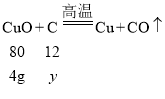
![]() y=0.6g
y=0.6g
猜想Ⅲ成立,说明生成的气体是一氧化碳和二氧化碳的混合物,故参加反应的碳粉的质量m的取值范围是:0.3g<m<0.6g;
交流反思:该反应可能生成一氧化碳,一氧化碳具有可燃性,混有一定量的空气,遇高温容易发生爆炸,故实验开始前缓缓通入氮气的目的是:排尽装置内的空气,防止加热时发生爆炸,防止空气中的成分干扰实验。

