【题目】已知:Cu2O+H2SO4═Cu+CuSO4+H2O.16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,将此混合物溶于足量的100.0g稀H2SO4得9.6gCu.下列说法正确的是( )
A. 生成2.4g CO2
B. 混合物中含9.6g铜元素
C. 混合物中Cu与Cu2O的质量之比为8:9
D. 反应后溶液中CuSO4的质量分数约为7.0%
参考答案:
【答案】C
【解析】解:设13.6g的混合物中Cu2O的质量为x,生成的硫酸铜的质量为y;
Cu2O+H2SO4═Cu+CuSO4+H2O 固体质量差量
144 64 160 144-64=80
x y 13.6g-9.6g=4g
![]() ,
, ![]() ;
;
x=7.2g,y=8g;
反应后溶液中CuSO4的质量分数为![]() ×100%≈7.7%,故D错误;混合物中Cu与Cu2O的质量之比为(13.6g-7.2g):7.2g=8:9,故C正确;根据铜元素过程中质量不变,所以铜元素的质量为9.6g+8g×
×100%≈7.7%,故D错误;混合物中Cu与Cu2O的质量之比为(13.6g-7.2g):7.2g=8:9,故C正确;根据铜元素过程中质量不变,所以铜元素的质量为9.6g+8g×![]() ×100%=12.8g,故B错误;16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,根据质量守恒可知,固体质量减少量为失去的氧元素的质量,故失去的氧元素的质量为16.0g-13.6g=2.4g,由于氧化铜和一氧化碳反应,生成的二氧化碳中的一半的氧元素来自氧化铜,所以对应的二氧化碳的质量为2.4g÷(
×100%=12.8g,故B错误;16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,根据质量守恒可知,固体质量减少量为失去的氧元素的质量,故失去的氧元素的质量为16.0g-13.6g=2.4g,由于氧化铜和一氧化碳反应,生成的二氧化碳中的一半的氧元素来自氧化铜,所以对应的二氧化碳的质量为2.4g÷(![]() ×100%×12)=6.6g,故A错误。故选C。
×100%×12)=6.6g,故A错误。故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】自来水消毒过程中常发生下列转化:
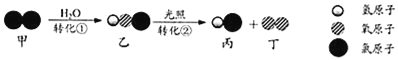
下列说法正确的是( )
A. 转化过程中有两种氧化物
B. 转化①是化合反应
C. 转化②中丙和丁的分子个数之比为1:1
D. 转化①、②中氯元素的化合价都发生变化
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A. 同种分子构成的物质是纯净物,纯净物一定由同种分子构成
B. 某物质燃烧生成CO2和H2O,该物质中一定含有C、H、O元素
C. 置换反应生成单质和化合物,生成单质和化合物的反应一定是置换反应
D. 某化肥与熟石灰研磨,无刺激性气味,该化肥一定不是铵态氮肥
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列排序正确的是( )
A. 空气中物质含量:
B. 溶液pH:

C. 金属活动性顺序:

D. 硫元素质量分数:

-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为海水吸收CO2并进行碳循环的原理.下列说法错误的是( )
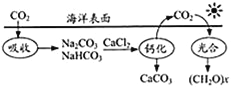
A. 光合中太阳能转化为化学能
B. 此碳循环中将CO2转化为无机物和有机物
C. 吸收的CO2与钙化中释放的CO2的量相等
D. 钙化中释放CO2的反应为:2NaHCO3+CaCl2=CaCO3↓+CO2↑+2NaCl+H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】MgSO4和Na2CO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
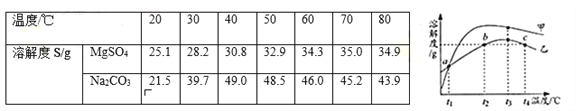
A. 甲为Na2CO3
B. 乙的饱和溶液从t1升温到t4,溶质质量分数增大
C. 等质量甲、乙饱和溶液从t3降温到t1,析出晶体的质量(不带结晶水):乙>甲
D. b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定质量的Ba(OH)2溶液中先后滴加CuSO4、H2SO4溶液,过程中加入溶液的质量与产生沉淀的质量关系如图所示.下列说法正确的是( )
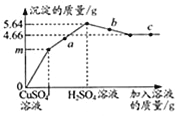
A. a点对应溶液pH>7
B. b点对应溶液中溶质有2种
C. m=3.31
D. 取c点对应溶液,滴加NaOH溶液,立刻产生沉淀
相关试题

