【题目】氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:
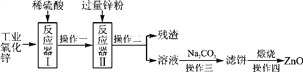
参考资料:SiO2既不溶于水也不与酸反应。
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为________________________________________________________________________。
(2)残渣中除金属锌外,还有________。
(3)操作一、操作二和操作三采用的分离方法是________。
(4)操作四发生反应的化学方程式为________________________________。
参考答案:
【答案】 ZnSO4、CuSO4、FeSO4 Cu、Fe 过滤 ZnCO3![]() ZnO+CO2↑
ZnO+CO2↑
【解析】(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成的硫酸盐有ZnSO4、CuSO4、FeSO4.(2)残渣中除金属锌外,还有SiO2等.(3)操作一、操作二和操作三采用的分离方法是过滤,通过过滤能够把固体和液体分离.(4)操作四中,高温条件下,碳酸锌分解生成氧化锌和二氧化碳,反应的化学方程式为:ZnCO3![]() ZnO+CO2↑.
ZnO+CO2↑.
-
科目: 来源: 题型:
查看答案和解析>>【题目】现将CO、CO2和O2各1mol在一密闭容器中充分反应,冷却后该容器内的碳、氧原子的个数比为
A、1:1 B、1:2 C、2:3 D、2:5
-
科目: 来源: 题型:
查看答案和解析>>【题目】20℃时,分别将50g水倒入盛有20gNaCl和KNO3固体的烧杯中,充分搅拌,随温度变化,实验现象如图1所示.
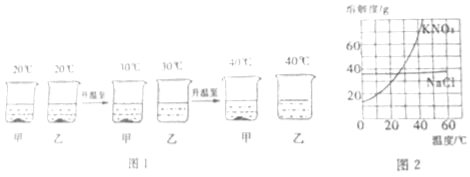
请参考NaCl和KNO3的溶解度曲线(如图2)回答:
(1)分析实验现象,甲、乙烧杯中对应的物质分别是 ,判断依据是 ;
(2)30℃时,甲、乙两溶液溶质质量分数的关系是:甲 乙(填“>“、”<“或“=”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据反应3Cu +8HNO3 →3Cu(NO3)2 + 2X↑ +4H2O 推断X的化学式为
A.N2 B.NO C.NO2 D.N2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积.
出现这种现象的可能原因是 ;
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe═3FeCl2 ②CuCl2+Fe═FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等.
①固体沉积物质量与加入铁粉质量相等的原因是 ;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是 ,反应②消耗铁粉的质量是 (计算结果精确到0.1).
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)某实验小组利用如图实验装置探究二氧化碳的化学性质:
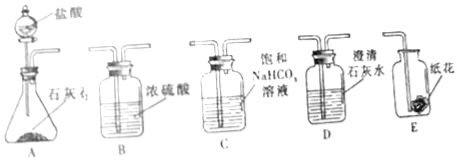
请根据实验装置和实验内容,回答下面问题:
①探究二氧化碳与碱反应时,将装置A生成的二氧化碳气体通入装置D未出现浑浊,原因是 ;可将二氧化碳先通过装置 ,再通入装置D,理由是 (用化学方程式表示);
②探究二氧化碳与水反应时,实验分两步进行:首先将二氧化碳通过石蕊溶液浸泡的干燥纸花,再将二氧化碳通过石蕊溶液浸泡的湿润纸花,这样做的目的是 ;结合上面实验,装置正确的连接顺序是 (填序号)
(2)家庭生活中食品制作(如面条、馒头等)经常用到食用碱,食用碱的主要成分是碳酸钠,可能含有少量氯化钠.小莉将家中食用碱带到实验室进行探究,请设计实验验证小莉提供的食用碱样品是否含有氯化钠.
实验步骤
实验现象
结论与解释
1.取一定量的食用碱样品放入试管,加入蒸馏水、振荡
样品溶解
食用碱溶于水
2.
3.
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质的溶解度曲线如右图所示。下列说法正确的是
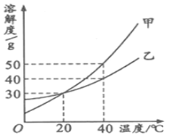
A.20℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B.将40℃时甲的一定量饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
相关试题

