【题目】人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略)。
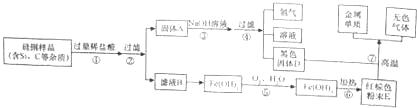
查阅资料发现:
常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H2O═Na2SiO3+2H2↑)。
根据以上信息,回答下列问题:
(1)固体A的成分为 ,E的化学式为 。
(2)滤液B中的金属阳离子为 。
(3)在过滤操作时,若发现滤液浑浊,应 。
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式 。
参考答案:
【答案】
(1)碳、硅 Fe2O3;
(2)Fe2+
(3)查找原因,处理后重新过滤
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
试题分析:
(1)硅钢中的铁和盐酸反应会生成氯化亚铁和氢气,所以滤液B是氯化亚铁,固体A中含有碳、硅,硅和氢氧化钠溶液反应会生成硅酸钠和氢气,所以黑色固体D是碳,氢氧化铁加热生成氧化铁和水,所以E是氧化铁,氧化铁和碳在高温的条件下生成铁和二氧化碳,经过验证,推导正确,所以A是碳、硅,E的化学式为:Fe2O3;
(2)硅钢中主要含有Fe、C、Si,只有Fe能与稀盐酸反应生成氯化亚铁,所以剩余的固体A的成分中含有C、Si,滤液B中的金属阳离子为Fe2+;
(3)在过滤操作时,若发现滤液浑浊,应查找原因,处理后重新过滤;
(4)步骤⑤中发生的是化合反应中,反应物是Fe(OH)2与氧气和水,生成物是氢氧化铁,化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我市某著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板。原理是:发电过程中产生的烟气中含有大量的SO2,热电厂用“碱﹣石灰﹣石膏CaSO42H2O)”的方法使烟气脱硫从而生成石膏。
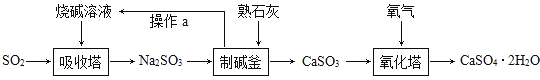
(1)工业烟气没经处理直接排放到空气中易形成______,会污染、破坏环境;
(2)写出吸收塔内发生反应的化学方程式_______,工业上用分离液态空气法制氧气:是利用空气中各成分的___不同进行分离的;
(3)化学反应类型有不同的分法,其中反应前后,有元素化合价变化的化学反应是氧化还原反应。有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂。化学反应前后元素化合价没有变化的化学反应是非氧化还原反应。则下列说法正确的是_____
A.吸收塔、制碱釜中发生的反应属于氧化还原反应
B.制碱釜中的反应物Na2SO3作氧化剂
C.氧化塔中发生的反应属于氧化还原反应
D.氧化塔中的反应物CaSO3作还原剂
(4)生产流程中生成的______可循环利用,节约成本。
-
科目: 来源: 题型:
查看答案和解析>>【题目】维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、 、维生素、无机盐和水。α﹣丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“﹣”表示原子之间相互连接),试计算:
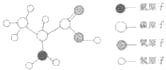
(1)α﹣丙氨酸的化学式量(或相对分子质量)为 。
(2)α﹣丙氨酸中碳元素、氢元素、氧元素的质量比为 。
(3)17.8gα﹣丙氨酸中含氮元素的质量为 g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列除杂方法(括号内为杂质)不正确的是
A.NaCl溶液(泥沙)→蒸发溶剂 B.KCl(K2CO3)→加入适量稀盐酸
C.CaO(CaCO3)→高温煅烧 D.CO2(H2O)气体→通过浓硫酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】徐州地铁一号线将于2019年底竣工并投入运营,市民出行将更加方便快捷。以下地铁建设涉及的材料中,属于无机材料的是
A.掘进机钻头是铬钼钢合金 B.防水材料使用了聚氯乙烯
C.皮带运输机用到了合成橡胶 D.地下主体结构使用了钢筋混凝土
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的结构决定性质,下列有关说法错误的是( )
A.过氧化氢与水化学性质不同的原因是由于分子构成不同
B.盐酸与硫酸化学性质相似的原因是在水溶液中都含有H+
C.氢氧化钠与氢氧化钙化学性质相似的原因是在水溶液中都含有OH﹣
D.金刚石与石墨物理性质差异较大的原因是由于碳原子的结构不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据如图所示装置回答下列有关问题:
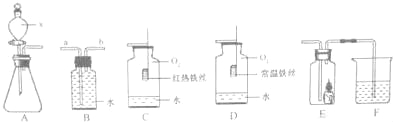
(1)仪器x的名称是 。
(2)若用装置B收集氧气,进气口应为 端(选填“a”或“b”)。
(3)对比装置C和D,可以得出关于可燃物燃烧的条件是 。
(4)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同。
①若实验时E中蜡烛熄灭,F中溶液变浑浊,则E中现象说明A中产生的气体所具有的性质是 。
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为 。
相关试题

