【题目】用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如下图所示:
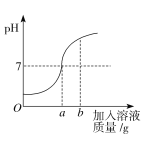
(1)该实验是将________________(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入溶液的质量为bg时,溶液中的溶质是________________________。
(3)当加入溶液的质量a为40 g时,求所得溶液中溶质的质量。
参考答案:
【答案】(1)氢氧化钠溶液 (2)NaCl和NaOH (3)5.85g
【解析】
试题分析:(1)图像起始点的pH小于7,反应中逐渐增大,说明是将氢氧化钠溶液滴加到盐酸中
(2)当加入溶液的质量为bg时,pH大于7,说明氢氧化钠过量,溶质为生成的NaCl和过量的NaOH
(3)由氢氧化钠溶液的质量和其溶质的质量分数可求出反应的氢氧化钠的质量,然后由方程式可计算出生成的氯化钠的质量
解:设所得溶液中溶质的质量为x
NaOH + HCl = NaCl + H2O
40 58.5
40g×10% x
40:58.5=(40g×10%):x
X=5.85g
答:所得溶液中溶质的质量为5.85g
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是高温下某反应的微观过程。下列说法中正确的是
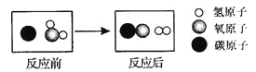
A.该反应属于复分解反应 B.该反应中元素的化合价没有变化
C.图中的两种化合物都属于氧化物 D.该反应所得生成物的质量比为1:1
-
科目: 来源: 题型:
查看答案和解析>>【题目】酸类物质具有相似的化学性质的本质原因是
A.都能与酸碱指示剂作用
B.都能电离出氢离子
C.都含有氢元素
D.都有酸根离子
-
科目: 来源: 题型:
查看答案和解析>>【题目】(12分)金属元素与人类关系密切.
(1)高钙豆奶粉中的“钙”指的是__________(填“元素”“原子”或“分子”)
(2)地壳中含量最高的金属元素是________(填符号,下同),海水中含量最高的金属离子是_____.
(3)铝可制成蒸锅,主要利用铝的延展性和________性.
(4)药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,治疗胃酸过多症,该反应的化学方程式为____________________________________________.
(5)人类向大自然提取量最大的金属是铁。写出高温下一氧化碳把铁从赤铁矿石中还原出来的化学方程式:________________________________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的溶液混合后,不发生反应的是
A.硫酸铜和氢氧化钠
B.盐酸和硫酸
C.碳酸钠和盐酸
D.硫酸和氢氧化钠
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质能使紫色石蕊试液变蓝的是
A.氧化钠 B.氢氧化镁 C.氯化银 D.二氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】(10分)人被蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处又痛又痒。化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究。
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;
II.蚁酸在隔绝空气并加热的条件下会分解生成两种氧化物。
[实验探究]
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成 色,说明蚁酸溶液显酸性;
(2)小芳同学根据蚁酸中含有 元素,推测出一种生成物是水;
(3)另一种生成的氧化物是气体,小敏提出两种猜想:
①猜想I:该气体是CO2;猜想II:该气体是 ;
他们将蚁酸分解产生的气体通过下图的装置。
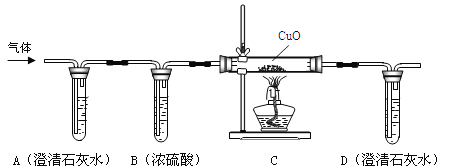
②实验时装置A中无明显变化,则猜想I (填“成立”或“不成立”);若猜想II成立,则:
③实验时装置B的作用是 ;
④实验时装置C中的现象是 ;
⑤实验时装置D中发生反应的化学方程式为 ;
[讨论交流]从环保角度看,该装置存在明显的缺陷,处理方法是 ;
[拓展延伸]当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是 。
A.苏打水 B.肥皂水 C.食醋 D.氨水
相关试题

