【题目】化工生产中需要对原料提纯,以有利于提高产品质量。经测定某氯化钠样品中混有硫
酸钠、氯化钙和氯化镁杂质,为了除去杂质并制得纯净的氯化钠固体,在实验室研究中某
同学设计了如下步骤:①过滤;②加入碳酸钠溶液,充分反应;③加热蒸发结晶;④加入
氯化钡溶液,充分反应;⑤加过量水溶解,并用玻璃棒搅拌;⑥加入稀盐酸,充分反应
⑦加入氢氧化钠溶液,充分反应
(1)以上步骤只能使用一次,正确的顺序是(________)(写序号);
A、⑤④⑦②①⑥③ B、⑤②⑦④⑥①③ C、⑤⑦④②①⑥③ D、⑤⑥④②⑦①③
(2)操作④中能否使用硝酸钡溶液?并说明理由。
(3)在实验中如何判断硫酸钠已除尽?
(4)操作①、③中都要用到玻璃棒,玻璃棒的作用分别是什么?
(5)现取10g只含硫酸钠杂质的粗盐样品,加入40g水中使之充分溶解。向盛有粗盐的烧杯中加入100g过量的氯化钡溶液。充分反应后,过滤,滤出沉淀物,测得烧杯中溶液质量147.67g。求粗盐样品中氯化钠的纯度。
参考答案:
【答案】(1)AC;(2)不能,因为会引入新的杂质硝酸根离子。(3)取上层清液少量于试管中,加入硝酸酸化的硝酸钡溶液,若无明显变化,则说明硫酸钠已除尽。(4)过滤:引流; 蒸发:搅拌使均匀受热,防止因局部温度过高造成液滴飞溅。(5)85.8%
【解析】除去杂质的原则是所加试剂只与杂质反应,且不引入新的杂质。(1)反应要在溶液中进行,故先溶解于水,加入氯化钡溶液是除去硫酸钠,加入氢氧化钠是除去氯化镁,加入碳酸钠是除去氯化钙,为保证杂质完全被除去,所加入的物质应该过量。A、无杂质出现,正确;B、有杂质氯化钡,且应该过滤后再加入稀盐酸,错误;C、无杂质出现,正确;D、要最后加入盐酸除去杂质,错误。故选AC。(2)不能,因为会引入新的杂质硝酸根离子。(3)取上层清液少量于试管中,加入硝酸酸化的硝酸钡溶液,若无明显变化,则说明硫酸钠已除尽,因为Ba(NO3)2 + Na2SO4=2NaNO3+ BaSO4↓(4)过滤操作中玻璃棒的作用是引流,蒸发操作中玻璃棒的作用是搅拌使均匀受热,防止因局部温度过高造成液滴飞溅。
(5)反应生成沉淀的质量为:(10g+40g+100g)-147.67g=2.33g,设粗盐样品中硫酸钠的质量为X,
BaCl2 + Na2SO4=2NaCl + BaSO4↓
142 233
X 2.33g
![]() =
=![]() 解得X=1.42g
解得X=1.42g
粗盐样品中氯化钠的质量为:10g-1.42g=8.58g
故粗盐样品中氯化钠的纯度为: ![]() ×100%=85.8%
×100%=85.8%
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是某盐酸试剂瓶标签上的部分说明。

(1)取10 mL 该盐酸可配制成 5% 的盐酸 g;
(2)配制溶液时,部分错误操作会使溶质的质量分数出现偏差。如配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液中溶质的质量分数偏小? (写序号)
①用量筒量取水时仰视读数;
②往烧杯中加水时有水溅出;
③称量含有不溶性杂质的食盐来配制溶液;
④将配置好的溶液往试剂瓶中转移时有少量溅出。
(3)打开瓶盖时,用蘸有浓氨水的玻璃棒靠近瓶口,会产生大量白烟,解释这一现象。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生反应。其中C物质的溶液呈蓝色,A与E反应生成的气体是光合作用的原料之一。(提示:碳酸钡不溶于水)
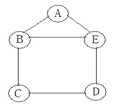
(1)C物质的化学式是____________;
(2)A与E反应的化学方程式_______________________________;
(3)按游戏规则,下列能替代D物质的是________(填序号).
①氧化铁 ②银 ③氯化钠 ④氢氧化钾
-
科目: 来源: 题型:
查看答案和解析>>【题目】对于氯原子和氯离子的认识中,不正确的是
A.质子数相同 B.电子数相同 C.电子层数相同 D.化学性质不相同
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的用途是利用其化学性质的是
A.氧气供给呼吸 B.液氮做制冷剂
C.稀有气体用于霓虹灯 D.铜线制电缆
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列符号中,既表示一种元素、又表示该元素的一个原子、还能表示一种物质的是
A.N B.H2 C.2Fe D.He
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列现象或事实能用分子的知识进行解释,其中不正确的是
现象或事实
解释
A
在花园中可以闻到花香
分子在不断运动
B
物质热胀冷缩
分子大小随温度改变而改变
C
100mL酒精和100mL水混合,体积小于200mL
分子间有间隔
D
水通电分解
在化学变化中分子可以再分
相关试题

