【题目】(11分)某课外活动小组的同学查阅资料得知,传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐。该小组的同学将这三种物质混合后加入适量的水搅拌、过滤得滤渣和滤液,并对料浆澄清液(“滤液”)的主要成分进行探究。
【提出问题】
料液的主要成分(H2O除外)是什么?
【关于料液的猜想】
小东认为:滤液中含有NaCl、Na2CO3、Ca(OH)2
小西认为:滤液中含有NaCl、NaOH、Na2CO3
小南认为:滤液中含有NaCl、NaOH、Ca(OH)2
小北认为:滤液中含有NaCl、NaOH
(1)大家讨论后一致认为 的猜想一定不成立,理由是(用化学方程式表示) 。
【设计实验探究】

(2)根据实验①可知 的猜想不成立,根据实验③可知 的猜想成立,通过实验②无法判断小西的猜想能否成立,理由是 。
【应用拓展】
(3)松花蛋味道鲜美,但直接食用会稍有涩味。如果将松花皮蛋蘸上食醋食用,则轻微涩味会被去除,味道变得更为鲜美可口。请你说明食醋可以去除松花皮蛋涩味的原因__________ 。
(4)现在有的皮蛋厂直接用烧碱(NaOH)代替生石灰和纯碱,但制得的皮蛋口感却不鲜美。烧碱一定要密封保存,其理由是____________(选序号填空)。
A.烧碱易吸水潮解 B.烧碱易吸收空气中的CO2而变质
C.烧碱具有强腐蚀性 D.烧碱溶于水时放出热量
(5)假设小西的猜想是合理的,只用稀盐酸对废水进行处理,回收氯化钠溶液。操作及判断反应完全的方法为 。
参考答案:
【答案】(1)小东 Na2CO3+Ca(OH)2===2NaOH+CaCO3↓
(2)小南 小西 盐酸的量太少,无法确定Na2CO3(溶液)是否存在。
(3)食醋中的酸(或醋酸)中和残留在皮蛋中的碱
(4)A、B
(5)边滴加稀盐酸边搅拌,至恰好不再有气泡冒出
【解析】
试题分析:(1)小东的猜想中的碳酸钠会和氢氧化钙发生反应,不能共存,所以小东的猜想错误,相应的方程式为; Na2CO3+Ca(OH)2===2NaOH+CaCO3↓;(2) 根据实验①可知小南的猜想不成立,根据实验③可知小西的猜想成立,通过实验②无法判断小西的猜想能否成立,理由是盐酸的量太少,无法确定Na2CO3(溶液)是否存在。【应用拓展】(3)食醋可以去除松花皮蛋涩味的原因食醋中的酸(或醋酸)中和残留在皮蛋中的碱;(4)根据氢氧化钠在空气中易吸收空气中的水分而潮解,易于空气中的二氧化碳反应而变质,故选择AB;(5)只用稀盐酸对废水进行处理,回收氯化钠溶液。操作及判断反应完全的方法为边滴加稀盐酸边搅拌,至恰好不再有气泡冒出。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(3分)柴油机尾气中的主要污染物是氮氧化物,某种尾气处理技术是利用氨气与氮氧化物发生化学反应,降低污染物排放,其中一个反应的微观示意图如下所示。
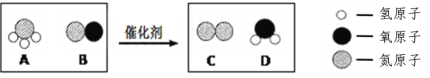
回答以下问题:
(1)A中氮元素的化合价为 。
(2)A分子、B分子、C分子的相同点是都含有氮 (填“分子”“原子”或“元素”) 。
(3)参加反应的A与B的分子个数比为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某元素的阳离子A3+的核外有23个电子,核内有30个中子,则该元素原子的核电荷数和相对原子质量分别为
A.23,53 B.26,30 C.26,56 D.23,46
-
科目: 来源: 题型:
查看答案和解析>>【题目】X可以有如下反应:1. X+酸=盐+水;2. X+非金属氧化物=盐+水。X可能是
A. 氧化铜 B. 盐酸 C. 碳酸钠 D. 氢氧化钠
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)钙是维持人体正常功能所必需的元素,有时需要服用补钙剂满足人体需求。下图分别为两种补钙剂说明书的一部分。

请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足够量的钙,才能避免 (填字母序号)。
A.佝偻病或骨质疏松症
B.贫血症
C.甲状腺肿大
(2)葡萄糖酸钙中钙元素的质量分数为 (计算结果精确到0.1%)。
(3)每片金钙尔奇中含碳酸钙的质量为 mg。
(4)按照葡萄糖酸钙说明书每日的补钙量,若改用金钙尔奇,一日2次,一次应服用 片。
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于水的说法中正确的是
A.水由一个氧元素和两个氢元素组成
B.水由氢原子和氧原子构成
C.水由氢元素和氧元素组成
D.水由一个氧原子和两个氢原子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】恰当的安全措施能减少生命财产损失.下列事故处理措施正确的是
A. 不小心将酒精洒在桌面燃烧起来,立即用湿抹布扑灭
B. 电器着火,立即用水扑灭
C. 高层住房内着火,立即打开门窗
D. 煤气泄漏,立即开启排气扇
相关试题

