【题目】将一定质量的氧化铜粉末加入到100g质量分数为14%的硫酸溶液中,微热至氧化铜全部溶解,再向蓝色溶液屮加入Wg铁粉,充分反应后,过滤、烘干,得到干燥的固体混合物仍是Wg。下列说法不正确的是
A. W的取值范围是W≥8g B. 加入氧化铜的质量是10g
C. 最后得到溶液溶质质量分数约是19.7% D. 产生气体的质量为0.07g
参考答案:
【答案】D
【解析】解法一:
设原先氧化铜的质量为m,则与氧化铜反应的硫酸的质量x,生成硫酸铜的质量y。
CuO+H2SO4═CuSO4+H2O
80 98 160
m x y
![]()
x=![]()
y=2m
设加入铁粉与硫酸铜溶液充分反应固体增加的质量为a;与剩余稀硫酸反应的铁的质量为b,同时放出氢气质量为c。
Fe+CuSO4═FeSO4+Cu 固体质量增加
56 160 64 64-56=8
2m a
![]()
a=0.1m
Fe+H2SO4═FeSO4+H2↑
56 98 2
b 14g-![]() c
c
![]() b=8-0.7m
b=8-0.7m
反应前后固体质量不变,即与硫酸反应消耗铁的质量等于与硫酸铜反应固体增加的质量,即:a=b,0.1m=8-0.7m,解得m=10g,b=1g。
![]() ,由于b=1g,所以有:
,由于b=1g,所以有:
![]()
c≈0.04g
由题意可知,硫酸最终全部转化为硫酸亚铁,设硫酸亚铁的质量为z。
H2SO4~FeSO4
98 152
100g×14% z
![]()
Z=![]()
加入铁粉的质量W=![]() ×
×![]() ×100%=8g;
×100%=8g;
最后得到溶液的质量分数=![]() ×100%≈19.73%
×100%≈19.73%
故选D。
解法二:
根据加入铁粉后,固体质量相等,则说明反应消耗铁粉的量等于析出金属铜的质量。
反应过程中存在如下转化关系:
H2SO4![]() H2SO4、CuSO4
H2SO4、CuSO4![]() FeSO4
FeSO4
则存在关系式:H2SO4 ~ Fe ~ FeSO4
98 56 152
100 g×14% x w
解得x =8 g,w =21.7 g,则反应生成铜的质量为8 g,根据质量守恒定律可知氧化铜的质量为8 g ÷![]() =10 g,则A、B项正确。
=10 g,则A、B项正确。
设与氧化铜反应的硫酸的质量y,生成硫酸铜的质量z。
CuO+H2span>SO4═CuSO4+H2O
80 98 160
10 g y z
解得y=12.25 g,z=20 g,则剩余H2SO4的质量为100 g×14%-12.25 g=1.75 g
设反应生成氢气的质量为m。
Fe+H2SO4═FeSO4+H2↑
98 2
1.75 g m
解得m =0.036 g,则D项错误。
则最后所得硫酸亚铁溶液的溶质质量分数为:![]() =19.7%,C项正确。
=19.7%,C项正确。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小英同学用某铁合金样品做了如下实验:称量11.4g样品,放入质量为40g的烧杯中,再往烧杯中加入200g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内物质总质量为251g。求:
(1)反应产生的氢气质量为__________g;
(2)所用稀硫酸的溶质质量分数________________(写出计算过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如右下图。下列说法正确的是( )
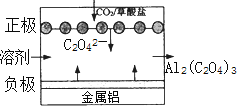
A. 该转置是将电能转变为化学能
B. 电池工作过程中,CO2中碳元素化合价升高
C. 铝能导电,作负极,电池工作过程中只发生物理变化
D. 该技术发展前景是捕捉大气中的CO2改变地球变暖的趙势
-
科目: 来源: 题型:
查看答案和解析>>【题目】生物体中含有多种氨基酸(结构如图所示)。下列有关叙述正确的( )
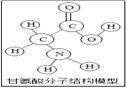
A. 甘氨酸是有机高分子化合物
B. 一个甘氨酸分子中含有10个原子
C. 甘氨酸是由碳、氢、氧、氮四种原子构成的
D. 甘氨酸中碳元素与氧元素的质量比为1:1
-
科目: 来源: 题型:
查看答案和解析>>【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示原理,包含了氯碱工业,电解法制取金属钠,侯氏制碱,生产盐酸,制取漂白粉(有效成分是 Ca(ClO)2),部分生成物己省略,下列说法正确的是
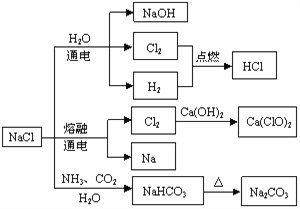
A. Na2CO3的热稳定性比NaHCO3差
B. 氯碱工业制得纯碱
C. 侯氏碱法的产品是NaHCO3
D. 工业制取漂白粉采用的是氯气和石灰乳反应,而不是氯气和石灰水
-
科目: 来源: 题型:
查看答案和解析>>【题目】创新发展材料技术可推动人类社会进步。
(1)碱式碳酸铝镁[AlaMgb(OH)c(CO3)·xH2O]既可以用作抗酸药,也常用于制作阻燃材料其化学式中的a、b、c、d需满足的代数关系式为_________________________________。
(2)城市建没需要大量的钢材、水泥、玻璃等建筑材料,水泥和玻璃属于_______________材料,钢筋混凝土属于_____________________材料。
(3)纳米TiO2是一种性能优良的光催化剂,可将其制成环保涂料涂覆于建筑物表面,利用光催化作用产生的活性氧(O3)和雨水使空气中的SO2转化为H2SO4,并吸附在催化剂表面,从而改善城市空气质量。写出上述过程中发生反应的化学方程式_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下面是几种实验室制取气体的发生装置与收集装置
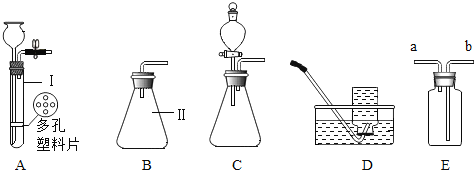
(1)写出仪器名称Ⅰ__________________,Ⅱ____________________。
(2)实验室制取氢气。若要较好地控制产生氢气的速度,应选用装置__________(填编号)
(3)D装置收集氢气,操作的正确顺序为____________(填编号)。
a.将导管伸入集气瓶口,气体进入瓶中 b.将装满水的集气瓶倒置在水槽中
c.当气体收集满时,用毛玻璃片上瓶口,将集气瓶移出水面放置
(4)若用E装置进行排空气法收集氢气,气体应从_______(填“a”或“b”)端进入
相关试题

