【题目】(9分)现有下列装置,回答问题:
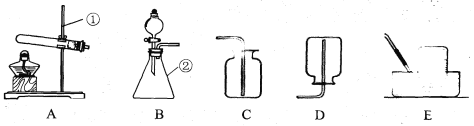
(1)写出有标号仪器的名称:① ,② ;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为 ,发生装置为 (填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有 (写一种即可);
(3)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
【实验内容】:
编号 | 实验内容 | 实验现象 | 实验结论 |
1 | 取反应后固体剩余物0.2g 加入5mL6%的 | 剧烈反应,放热 产生大量气泡 | 生成物中的 催化分解 |
2 | 取0.2g ( | 平稳反应,放热,持续产生气泡 |
分解 |
3 | 取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸 上无黑色固体残余物 | 固体剩余物中无 |
【实验分析】:
①完善上表中的填空内容:实验2 、实验3 ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
【资料】:在43.9℃~377.9℃范围中,![]() span>受热分解时,会发生以下两个反应:
span>受热分解时,会发生以下两个反应:
![]()
④取8.0g![]() ,加热使之完全分解,生成
,加热使之完全分解,生成![]() 的质量可能为 (填字母序号);
的质量可能为 (填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,![]() 在43.9℃一377.9℃范围中的失重率(
在43.9℃一377.9℃范围中的失重率(![]() 与
与![]() 的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,
的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,![]() 分解反应主要以 (填“a”或“b”)为主。
分解反应主要以 (填“a”或“b”)为主。
参考答案:
【答案】(1)①铁架台;②锥形瓶;
(2)2H2O2![]() 2H2O+O2↑;B ;减慢液体滴加速率或降低反应物的浓度或打开橡皮塞;
2H2O+O2↑;B ;减慢液体滴加速率或降低反应物的浓度或打开橡皮塞;
(3)①6%; MnO2 ②和实验1对比,确定二氧化锰的催化作用;
③实验3以证明了固体剩余物中无二氧化锰或二氧化锰难溶于水;
④C; ⑤ b
【解析】
试题分析:(1)根据所学知识可知①铁架台,②锥形瓶;
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为2H2O2![]() 2H2O+O2↑;发生装置为固液常温型装置B,若反应过于剧烈,可以采取的措施减慢液体滴加速率或降低反应物的浓度或打开橡皮塞;
2H2O+O2↑;发生装置为固液常温型装置B,若反应过于剧烈,可以采取的措施减慢液体滴加速率或降低反应物的浓度或打开橡皮塞;
(3)【实验分析】因为是对比试验,故①实验2填6%; 实验3中填MnO2 ②实验2的目的是和实验1对比,确定二氧化锰的催化作用;③经讨论,实验1的结论不正确,理由是实验3已证明了固体剩余物中无二氧化锰或二氧化锰难溶于水;④若发生的是a反应,设8.0gKMnO4,加热使之完全分解,生成O2的质量为x
6KMnO4![]() 2K2MnO4+K2Mn4O8+4O2↑
2K2MnO4+K2Mn4O8+4O2↑
6×158 4×32
8.0g x
![]() =
=![]()
x=1.08g
若发生的是b反应,设8.0gKMnO4,加热使之完全分解,生成O2的质量为y
KMnO4![]() KMnO2+O2↑
KMnO2+O2↑
158 32
8.0g y
![]() =
=![]()
y=1.62g
因为KMnO4受热分解,会发生以上两个反应,所以生成氧气的质量介于1.08g和1.62g之间,故C选项正确;
⑤由题意可知:KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%,据方程式可知:在a反应中失重率为:![]() ≈0.135,b反应中失重率为:
≈0.135,b反应中失重率为:![]() ≈0.201,可以发现,此时的失重率为18.0%,与b的失重率较为接近,故在43.9℃~377.9℃范围中,KMnO4分解反应主要以b为主。
≈0.201,可以发现,此时的失重率为18.0%,与b的失重率较为接近,故在43.9℃~377.9℃范围中,KMnO4分解反应主要以b为主。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质属于氧化物的是
A.冰水混合物 B.液氧 C.高锰酸钾 D.碳酸钙
-
科目: 来源: 题型:
查看答案和解析>>【题目】(7分)小红做蜡烛燃烧实验时,将内壁沾有澄清 石灰水的烧杯罩在蜡烛火焰上(如图1),观察到澄清石灰水变浑浊,化学反应方程式为 。小芳根据溶解度相关知识提出,该实验不能证明蜡烛燃烧生成了二氧化碳气体,你认为原因是 ;在不添加实验仪器和药品的情况下(不考虑水分蒸发),请设计一个实验验证蜡烛燃烧生成了二氧化碳气体 。小丽认为蜡烛燃烧时,还可能生成一氧化碳。
为验证是否生成了一氧化碳,他们设计了如图2所示的实验。
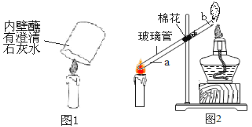
【实验验证】实验前,先在玻璃管的中部放入一团湿棉花,其目的是 。
实验中能证明蜡烛燃烧时会生成一氧化碳的现象是: 。
【拓展应用】含碳燃料不充分燃烧会生成一氧化碳等物质,浪费资源,且污染空气。为使其充分燃烧,应采取的措施是 (答一条即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)芬兰发明家马蒂·努尔米亚发明了一种中和处理二氧化碳的新方法,是将二氧化碳从火力发电厂的烟气中分离出来,放入含有长石成分的水溶液里进行中和处理。在反应过程中,长石的成分不仅能吸收二氧化碳,同时还会生成一些有用的副产品,这些副产品可用作生产铝的原材料和玻璃制造业。其主要流程可示意如下:
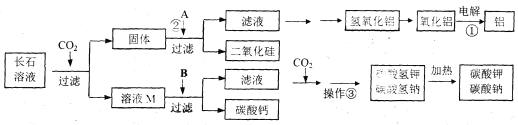
(1)发明家将CO2从火力发电厂的烟气中分离出来,通入含有长石的水溶液里吸收,从环保的角度看,这样做的意义是 ;
(2)长石是地壳中最常见的矿石,含量高达60%。长石主要包括钾长石
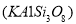 、钠长石
、钠长石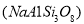 、钙长石(
、钙长石(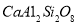 )。若钙长石吸收
)。若钙长石吸收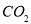 的反应方程式为:
的反应方程式为: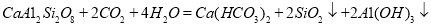
请模仿钙长石,写出钠长石吸收CO2的化学反应方程式 ;
(3)若A的pH小于7,试写出一个符合反应②的化学方程式 ;
(4)溶液M中的溶质为 ,B可用作改良酸性土壤,则B为 _ ;操作③主要目的为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的用途与性质不对应的是
A.食品包装中充氮气以防腐﹣﹣常温下氮气的化学性质不活泼
B.一氧化碳用于冶炼金属﹣﹣一氧化碳具有可燃性
C.稀有气体能制成多种用途的电光源﹣﹣稀有气体在通电时发出不同颜色的光
D.干冰可用做制冷剂﹣﹣干冰升华吸热
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)如图所示是医院常用的药瓶和注射器,请你据图回答:
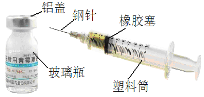
(1)含有金属材料的是 (写一种即可,下同),属于有机合成材料是 。
(2)注射器洗净后可以用于家庭小实验,可以代替 仪器使用。
(3)钢针一般用不锈钢制造,主要是由于其不容易生锈, 请你写出生活中防止铁制品生锈的方法(一条即可) 。
(4)铝的金属活性比铁强,请写出铝放入硫酸亚铁溶液中反应的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中正确的是
A.人体中含量最多的元素是氧元素 B.地壳中含量最多的金属元素是铁元素
C.空气中含量最多的元素是氧元素 D.海洋中含量最多的非金属元素是氯元素
相关试题

