【题目】过氧乙酸对细菌和病菌具有高效、快速杀灭作用,在抗击“非典型肺炎”的战役中被广泛应用于环境的消毒。如图为过 氧乙酸的结构式,下列有关过氧乙酸的叙述中不正确的是( )

A. 过氧乙酸分子的化学式为C2H4O3 B. 过氧乙酸的相对分子质量为76
C. 过氧乙酸中氢元素的质量分数最大 D. 完全燃烧生成H2O和CO2
参考答案:
【答案】C
【解析】根据化学式的意义解答。
A、由图中可知,该物质的一个分子中有2个碳原子、4个氢原子和3个氧原子,其化学式是C2H4O3,故A正确;
B、由于其化学式是C2H4O3,所以其相对原子质量是(12×2)+(1×4)+(16×3)=76,故B正确;
C、过氧乙酸中C、H、O元素的质量比是(12×2):(1×4):(16×3)=6:1:12,由此可知,过氧乙酸中氢元素的质量分数最小,故C错误;
D、由于其化学式是C2H4O3,含有碳、氢、氧元素,故完全燃烧生成H2O和CO2,故D正确。
故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属在生产、生活和实验中应用广泛。
(1)今年将开通南京至高淳的轻轨,其中用铜作导线,这是利用了铜的延展性和__________。
(2)写出用稀盐酸除铁锈的化学方程式________________。
(3)金属锈蚀会造成巨大浪费。下列做法能防止铁制品生锈的有__________。(填字母序号)
A.菜刀使用过后涂上食盐水 B.水龙头表面镀铬
C.自行车支架喷漆 D.保留铁栅栏表面的铁锈
(4)我国第五套人民币硬币:一元币为钢芯镀镍(Ni)合金,伍角币为钢芯镀铜合金。
已知镍能够发生如下反应:Ni +H2SO4 === H2↑+ NiSO4 ;Fe+ NiCl2 === Ni + FeCl2,
Fe、Cu、Ni三种金属的活动性由强到弱的顺序为____________。
(5)98克稀硫酸与6.5g锌恰好完全反应,生成氢气的质量是多少?_____(在答卷纸上写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】放入水中不能形成溶液的物质是
A. 白糖 B. 食盐 C. 花生油 D. 白酒
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质
X
Y
Z
Q
反应前的质量/g
4
10
1
25
反应后的质量/g
待测
21
10
9
下列说法中不正确的是( )
A、该反应为分解反应 B、该反应遵守质量守恒定律
C、X的待测值为零 D、若Q为氧气,则该反应为氧化反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】微量元素是人体必需的,摄入不足不利于人体健康,硒被誉为“抗癌元素”。根据如图提供的硒的有关信息,下列说法中,正确的是 ( )

A. 硒属于金属元素 B. 硒原子中的核内质子数是34
C. 硒的原子结构示意图中x=4 D. 硒的相对原子质量是78.96 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】随着科技的不断进步,太阳能路灯(如图所示)越来越多的出现在我们城市道路的两旁,节约能源的同时减少了环境的污染,是实现“低碳生活”的一种典型措施。请你根据图中内容回答下列问题:

(1)图中标示的物质属于金属材料的有 (一个即可,填序号,下同);属于有机合成材料的是 。
(2)各组成材料中属于单质的是 (填名称,一个即可);不锈钢属于 (填“纯净物”或“混合物”)。
(3)请用一个化学方程式证明铝比铜活泼 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
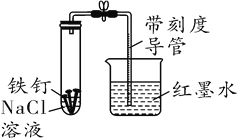
(1)实验前用10%的H2SO4溶液清洗铁钉至有气泡产生。用H2SO4溶液清洗的目的是__________。写出有关化学方程式______________________________。
(2)已知试管剩余空间和导管的体积为40 mL,导管截面积约为1 cm2,形成稳定液柱时,读取读数为8.2 cm。则空气中氧气的体积分数为______%。
(3)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
【提出假设】假设一:溶液的pH不同;
假设二:NaCl溶液的浓度不同;
请你再提出一种假设,假设三:______________________________不同。
【进行实验】借助上述实验装置,通过取体积、浓度相同NaCl溶液调节溶液的pH获得了如下实验数据:
pH
2.0
5.5
6.0
6.5
7.0
8.0
液柱高度(cm)
0
1.3
8.2
8.2
8.2
8.2
形成稳定液柱时间(min)
3.0
3.0
5.1
5.3
15.6
17.5
【实验结论】根据实验数据分析,为缩短实验测定时间,pH的最佳范围是____________。
【实验反思】当pH=2时,没有观察到稳定液柱形成的原因是________________。
【注意:如果能正确回答下列问题,将奖励4分,但化学试卷总分不超过60分】
请你设计实验,探究NaCl溶液的浓度对铁生锈速率的影响。
实验步骤: __________________________________________________________。
实验现象:________________________________________________________________。
相关试题

