【题目】同学们对实验“煅烧石灰石”展开深入探究。资料:石灰石中的杂质高温不分解。
①为证明石灰石已分解,三位同学设计方案如下:
Ⅰ.甲同学按图一进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 。

II.乙同学按图二进行试验,观察到B中液体变 色,A实验的作用 。
III.大家认为甲同学的方案不合理,请分析原因 。
IV.丙同学取一块质量为12.5g的石灰石煅烧,并记录有关数据如下表
时间(秒) | 0 | 60 | 120 | 180 | 240 | 300 |
固体质量(克) | 12.5 | 12.3 | 11.2 | 9.2 | 8.1 | 8.1 |
根据上述数据判断, 秒时,已经可以证明石灰石开始分解了。240秒时,石灰石已经完全分解了,理由是 。
②根据丙同学记录的数据,该石灰石分解共生成 克CO2,物质的量为 mol。根据化学方程式列式计算:这块石灰石中含碳酸钙的质量是 克。
参考答案:
【答案】①Ⅰ.Ca(OH)2+CO2=Ca CO3↓+ H2O II.红 对照作用或对比作用
III. 煤气燃烧也能产生二氧化碳,故无法判断 IV. 60秒 固体质量已不再发生改变
②4.4 0.1 10克
【解析】
试题分析:①Ⅰ.二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水:Ca(OH)2+CO2=====Ca CO3↓+ H2O;
II.碳酸钙分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙溶液呈碱性,能使无色酚酞试液变成红色,即试管B中滴加酚酞会变成红色;试管A起对照的作用;
III.由于煤气的主要成分是一氧化碳,一氧化碳燃烧会产生二氧化碳,会对实验造成干扰,故无法判断;
IV.由表格信息可知,在60s时,固体的质量款式减少,即碳酸钙发生了分解;在240s时固体的质量保持不变,即碳酸钙已经完全分解;
②由表格数据可知,固体减少的质量=12.5g-8.1g=4.4g ;物质的量 = 4.4g ÷ 44g /mol = 0.1mol;
利用化学方程式,根据反应的质量比即可计算出碳酸钙的质量;
设碳酸钙的质量无谓x;
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
X 4.4g
100/44 =x/4.4g
X=10g
-
科目: 来源: 题型:
查看答案和解析>>【题目】有三种金属X、Y 、Z,它们与酸或盐溶液可发生如下反应:①Y + X(NO3)2 = Y(NO3)2 + X ②X+H2SO4=XSO4+H2↑ ③Z不与盐酸反应。则该三种金属的活动性顺序为( )
A.X>Y>Z B.Z>Y>X C.Z>X>Y D.Y>X>Z
-
科目: 来源: 题型:
查看答案和解析>>【题目】热水瓶中少量水垢可用 除去。
A.稀盐酸 B.煤气 C.氢氧化钙 D.生石灰 E.硝酸钾
-
科目: 来源: 题型:
查看答案和解析>>【题目】把500L空气压缩到1L的钢瓶中,是因为( )
A.分子变小了 B.分子间的间隔变小了
C.分子静止了 D.分子破裂成了原子
-
科目: 来源: 题型:
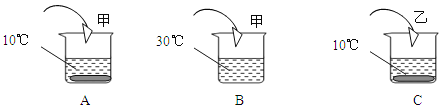
查看答案和解析>>【题目】A、B、C三个烧杯中都盛有40g水(其中A、C烧杯中水温为10℃,B烧杯中水温为30℃,不考虑溶解过程中温度的变化),分别加入甲、乙(均不含结晶水)两物质各10g,充分搅拌后所得现象如下图所示,试回答:
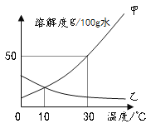
已知:甲、乙的溶解度随温度的变化如右图所示:
①30℃,甲与乙的溶解度关系甲 乙(填“=”或“>”、“<”);
②若将B中的溶液变为饱和溶液,还需加入物质甲 克;
③其它条件不变,将C烧杯中的温度升到50℃时,C烧杯中的溶液是 (填“饱和”或“不饱和”)溶液;
④10℃时,上述A、C烧杯中的溶液质量分数关系为A C(填“=”或“>”、“<”,下同)。其他条件不变,将温度升高,则A、C烧杯中的溶液质量分数关系为A C;
⑤30℃时,等质量的甲、乙饱和溶液,降温至10℃时,两溶液的质量关系:甲 乙。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学想研究不同的氧化物能否在氯酸钾制取氧气实验中起催化作用,进行了以下实验:
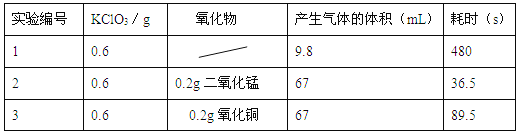
①写出实验2反应的化学方程式 ;
②为证明氧化铜是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤,将滤渣洗涤并干燥,用电子天平称量,质量为0.2g。
Ⅱ.将过量的CO通入滤出的固体,按右图进行实验:仪器a的名称 。
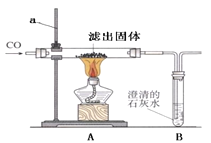
③甲同学的实验报告如下:
装置
现象
实验结论
A
黑色固体全部变红
生成了铜,反应方程式 (7)
B
石灰水变浑浊
产生了二氧化碳
Ⅲ.该实验装置存在的缺陷是
当出现 现象时,证明反应已经开始。
④以上实验证明氧化铜在反应前后质量和化学性质都没改变,能作为氯酸钾受热分解的催化剂。两种氧化物相比, 的催化效果更好。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学对蜡烛的燃烧进行探究:

①点燃一支蜡烛,用一只烧杯倒扣在燃着的蜡烛上,蜡烛燃烧片刻后熄灭,如实验一;
②吹灭燃着的蜡烛,看到烛芯产生一缕白烟,用火柴点燃白烟,蜡烛重新被引燃,如实验二;
③将粗细均匀的木条水平放在蜡烛的火焰上,稍加热后观察木条燃烧现象,如实验三。
Ⅰ.操作①中,蜡烛能燃烧片刻的原因是 ;
Ⅱ.操作②中,关于白烟的成分,有同学做出了下列猜想:A.白烟是水蒸气;B.白烟是石蜡固体小颗粒;C.白烟是二氧化碳。你认为上述猜想有道理的是(填序号) ;
Ⅲ.该同学在做实验一的过程中,发现罩在火焰上方的烧杯内壁被熏黑,你认为她的做法正确的是 (填序号)
A.反复实验,并观察是否有相同现象
B.查找资料,了解石蜡的主要成分,探究生成的黑色固体是什么
C.认为与本次实验目的无关,不予理睬
D.询问老师或同学,讨论生成黑色物质的原因
Ⅳ.实验三,木条处于外焰的部分最先变黑,说明蜡烛的外焰温度 。
相关试题

