【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为_______g。
(2)该黄铜中铜的质量分数为多少____________? (写出计算过程)
(3)第三次实验中溶质的种类为________________。
参考答案:
【答案】 0.2 67.5% 硫酸和硫酸锌(H2SO4, ZnSO4)
【解析】(1)由质量守恒定律可知,黄铜粉末完全反应生成氢气总质量为20g+60g-79.8 g=0.2g;
(2)解:设20克黄铜中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
![]()
x=6.5g
黄铜中铜的质量分数为![]() ×100%= 67.5%。
×100%= 67.5%。
(3)由于硫酸过量,第三次实验的溶质为硫酸和硫酸锌(H2SO4,ZnSO4)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂等,以高岭土[主要成分为Al2(Si2O5](OH)4]。烧碱等为主要原料生产分子筛的工艺流程如下:
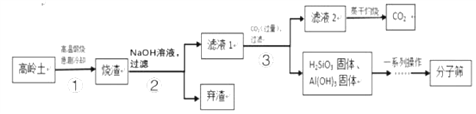
(1)步骤①所得烧渣中主要含有两种固体氧化物,分别为SiO2和_____(写化学式)
(2)步骤②加入NaOH溶液前需将烧渣粉碎,其目的是________________________。
(3)步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,该反应的化学方程式为___________________。
(4)上述流程中可以循环利用的物质(水除外)是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】兴趣小组的利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____________________。
[查阅资料] SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式:____________________________。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_________,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
实验操作
实验现象
如图所示,将产生的气体________________
_____________________
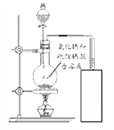
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为________________(填序号)。
A.加热氯化钠溶液和稀硫酸的混合物 B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全球最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想] 甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
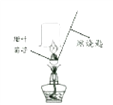
[讨论交流]其他同学认为小晴的实验设计不严谨,原因是____________________________。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用下图进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)
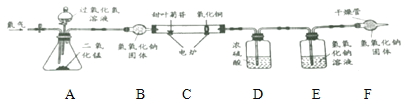
(1)实验前要通一会儿氮气,目的是_________________。
(2)A装置中发生反应的化学方程式为__________________________。
[数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g, E装置增重8.36g。(产物被完全吸收)
[分析与结论]数据分析: 4.02g 甜叶菊苷中氧元素的质量为___g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是_____________。 (填“偏大”、“偏小”或“无影响”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。某同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如下图所示。

(1)碳酸钙与稀盐酸反应的化学方程式______ 。
(2)下列有关说法正确的是______ (填字母序号)。
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸反应
B.对比分析c、d点可知,相同的气压时,碳酸钙粉末与稀盐酸反应速率更快
C.碳酸钙粉末产生的CO2质量多
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下列各图中提供的信息,回答问题:

(1)写出图中标号①的仪器名称_________。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,应选用的发生装置是_______ (填字母序号)。
(3)实验室若收集二氧化碳可选用的装置是____(填字母序号);若用排空气法收集氧气,检验氧气是否收集满的正确操作是____(填字母序号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在通常情况下,燃烧需要三个条件:_____;氧气(或空气);达到燃烧所需的最低温度(也叫着火点)。
(1)下面是探究燃烧条件的实验,请你根据实验图示和资料信息回答有关问题。
资料信息:白磷和红磷的着火点分别是40℃、240℃。
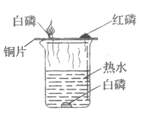
①铜片上的红磷不燃烧,是因为____________。
②烧杯中水的作用一方面_________,另一方面__________。
(2)为了防止失火造成生命财产的损害,加油站等场所常贴有下列图标,其中表示“禁止吸烟”的是____(填字母序号)。

相关试题

