【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液)。四组实验数据记录如右表。请分析计算:
(1)反应后,稀盐酸还有剩余的是第______组。
(2)求混合物中碳酸钙和氯化钙质量之比。
(3)表中a的值为_____。
(4)求表中m的值。
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g' | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/ | 0 | 0 | m | n |
参考答案:
【答案】(1)一和二 (2)5:1 (3)105.5 (4)1.25g
【解析】(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳是气体会逸散到空气中,故减少的质量即为生成的二氧化碳的质量。实验一中,生成的二氧化碳的质量=100g+3g-101.9g=1.1g;实验二中生成的二氧化碳的质量=100g+6g-103.8g=2.2g;实验二中溶液的质量增加了1.9g,实验三中溶液的质量只增加了1.2g,说明实验三中的碳酸钙没有完全反应,即稀盐酸已经完全反应,故实验一、二中的稀盐酸有剩余;
(2)利用化学方程式,根据碳酸钙与二氧化碳的质量比即可计算出碳酸钙的质量。
设3g混合物中碳酸钙的质量为x;
CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
100 44
X 1.1g
![]() x=2.5g
x=2.5g
碳酸钙和氯化钙质量之比="2.5g:0.5g=5:1" ;
(3)实验三中的稀盐酸已经完全反应,故实验四中增加固体的质量后,碳酸钙不反应,即所得溶液的质量和实验三中溶液的质量相等,即a=105.5g;
(4)实验三中的碳酸钙未完全反应,生成的二氧化碳的质量为和为反应的碳酸钙的质量之和=100g+9g-105g==4g,利用化学方程式,根据碳酸钙与二氧化碳的质量比即可计算出参加反应的碳酸钙的质量。
9g混合物中碳酸钙的质量=![]()
![]() 7.5g;
7.5g;
未反应的碳酸钙的质量为m;
CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
100 44
7.5g-m 4g-m
![]() m=12.5g
m=12.5g
答:混合物中碳酸钙和氯化钙质量之比为5:1 ;m为1.25g 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年年底,我国东北地区抗击暴风雪中融雪剂发挥了一定的作用。其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK)。请回答:
(1)醋酸钾中C、H、O元素的质量比为
(2)醋酸钾的相对分子质量为 ,钾元素的质量分数为 (保留一位小数)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我们每天生活在不断变化的物质世界里。下列变化属于化学变化的是
A.海水晒盐 B.食物腐败 C.汽油挥发 D.石油分馏
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学式正确的是: ( )
A.高锰酸钾(K2MnO4) B.氧化镁(MgO2) C.氯化钾(KClO3) D.氯化亚铁(FeCl2)
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有①硝酸钾 ②氯化钾 ③浓盐酸 ④浓硫酸 ⑤钨 ⑥铁,选择适当的物质填空。
(1)属于复合肥料的是______(填序号,下同);
(2)敞口放置在空气中质量减小的是__________;
(3)熔点最高的金属是_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年5月,我国在南海首次试采可燃冰成功。
材料一:可燃冰的化学式为CH4·8H2O,相对分子质量为160,它是由甲烷气体与不在高压低温条件下形成的类冰状水合物。可燃冰热值高、储藏量大。燃烧不产生污染物。
材料二:将CO2注入海底的可燃冰储层,能将可燃冰中的CH4“挤走”,而形成二氧化碳水合物。
回答下列问题:
(1)写出甲烷(CH4) 燃烧的化学方程式__________________________________。
(2)CH4·8H2O碳元素的质量分数为_______________。
(3)下列关于可燃冰的说法正确的是________。
A.可燃冰是一种清洁能源
B.甲烷和水形成可燃冰的过程是化学变化
C.用CO2 “挤走”可燃冰中的CH4过程属于置换反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】小柯探究pH对唾液淀粉酶活性的影响,其实验过程及结果如下:
组别
A
B
C
试管中依次
加入物质
1ml唾液
1ml唾液
1ml唾液
1ml盐酸溶液
1ml蒸馏水
1ml氢氧化钠溶液
2ml淀粉溶液
2ml淀粉溶液
2ml淀粉溶液
水浴10分钟
37℃
37℃
37℃
各滴入2滴
碘液后的现象
变蓝
不变蓝
不变蓝
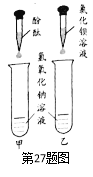
(1)B组实验不变蓝的原因是____________________。小柯观察到C组也不变蓝,认为氢氧化钠对酶的活性没有影响。老师提示他:“氢氧化钠会影响酶的活性。”那么,是什么原因导致C组没变蓝?小柯进一步分析并做出猜想。
猜想一:氢氧化钠变质。
猜想二:氢氧化钠与碘发生了化学反应。
……
(2)小柯按图甲实验,看到溶液变红,认为氢氧化钠没有变质。小常认为他的结论是
错误的,理由是_________________________。
在小常的建议下,小柯按乙实验,溶液中没有沉淀产生,从而排除了猜想一。
(3)在原来C组实验基础上,只要继续_______________________(写出操作和现象),就可以证明猜想二正确。
相关试题

