【题目】已知:Cu2O+H2SO4== Cu+CuSO4+H2O。将14.4g Cu2O、Cu混合物溶于100.0g溶质质量分数为9.8%的稀H2SO4中,搅拌使之充分反应,过滤、洗涤、干燥得10.4g固体。下列说法正确的是
A. 10.4g固体是反应生成的铜的质量
B. 反应后溶液呈蓝色,溶质只有一种
C. 原混合物中Cu2O与Cu的质量之比为1∶1
D. 反应后溶液中CuSO4的溶质质量分数为8.0%
参考答案:
【答案】C
【解析】A. 10.4g固体是反应生成的铜与混合物中的铜质量的总和,错误;B. 反应后溶液呈蓝色,说明溶液中有硫酸铜,也可能有剩余的硫酸,错误;C. 设固体混合物中Cu2O的质量为x,生成的Cu为y。
Cu2O+H2SO4== Cu+CuSO4+H2O
144 64
x y
![]() =
=![]() ,解得y=
,解得y=![]() ,根据题意可知,14.4g-x+
,根据题意可知,14.4g-x+![]() =10.4g,解得x=7.2g,则原混合物中Cu的质量为:14.4g-7.2g=7.2g,故原混合物中Cu2O与Cu的质量之比为1∶1,正确D. 设反应生成CuSO4的质量为w。
=10.4g,解得x=7.2g,则原混合物中Cu的质量为:14.4g-7.2g=7.2g,故原混合物中Cu2O与Cu的质量之比为1∶1,正确D. 设反应生成CuSO4的质量为w。
Cu2O+H2SO4== Cu+CuSO4+H2O
144 160
7.2g w
![]() =
=![]() ,解得w=8g
,解得w=8g
反应后溶液的质量为:14.4g+100.0g-10.4g=104g
反应后溶液中CuSO4的溶质质量分数为: ![]() ×100%=7.7%,错误。故选C。
×100%=7.7%,错误。故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为某反应的微观示意图,下列说法错误的是
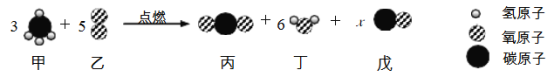
A. x=2
B. 该反应中有4种氧化物
C. 反应前后原子的种类、个数、质量都不变
D. 若反应中甲、乙的分子个数比为1∶2时,则无物质戊生成
-
科目: 来源: 题型:
查看答案和解析>>【题目】用CO2和X可合成尿素[CO(NH2)2]:CO2+2X
 CO(NH2)2+H2O。下列说法正确的是
CO(NH2)2+H2O。下列说法正确的是A. X中含有氧元素 B. 尿素中C、O、N、H的原子个数之比为1∶1∶1∶2
C. X的相对分子质量是34 D. 参加反应的CO2与X的质量比是22∶17
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合图回答问题
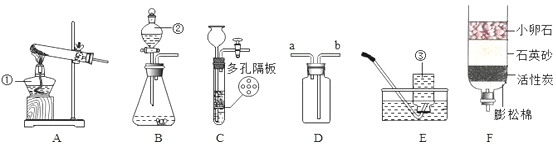
(1)仪器名称:①_____;②_____。
(2)用氯酸钾和二氧化锰制氧气,可选用装置_____(选填序号)和 E 组合,化学方程式 为_____,二氧化锰的作用是_____。
(3)实验室可用装置B或C制 H2,C 装置相对于B的优点有_____,用D装置收集 H2,气体应从_____(选填“a”或“b”)端通入。
(4)F 为简易净水装置,相当于化学实验中的_____装置。向该装置处理过的水中,加入少量肥皂水振荡,产生较多浮渣,说明是水_____(填“硬”或“软”),若要得到纯水,还需 要进行_____(填操作名称)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象表示对应反应过程的分析正确的是( )
A.
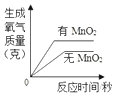 如图表示有、无 MnO2下等质量同浓度 H2O2溶液的分解
如图表示有、无 MnO2下等质量同浓度 H2O2溶液的分解B.
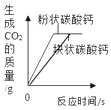 如图表示等质量粉末状和块状碳酸钙分别与足量同浓度稀盐酸的反应
如图表示等质量粉末状和块状碳酸钙分别与足量同浓度稀盐酸的反应C.
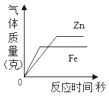 如图表示等质量的 Fe、Zn 与足量同浓度稀硫酸的反应
如图表示等质量的 Fe、Zn 与足量同浓度稀硫酸的反应D.
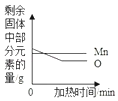 如图表示加热高锰酸钾制氧气时,固体中锰、氧元素的质量变化
如图表示加热高锰酸钾制氧气时,固体中锰、氧元素的质量变化 -
科目: 来源: 题型:
查看答案和解析>>【题目】硅(Si)是半导体材料,利用石英砂(主要成分是 SiO2)制取高纯度 Si,其流程图如图:
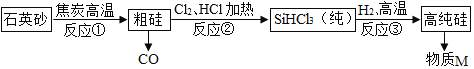
下列说法正确的是( )
A. 反应①、③为置换反应
B. 反应①产生的尾气可直接排放
C. 该过程中各元素的化合价均发生了变化
D. 反应③为 SiHCl3+H2
 Si+3M,M 可循环使用
Si+3M,M 可循环使用 -
科目: 来源: 题型:
查看答案和解析>>【题目】有Mg、Fe、Cu的混合粉末,分离并得到MgSO4·7H2O过程如下:
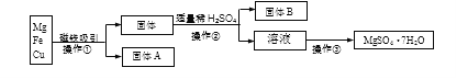
(1)固体A是____________________。
(2)操作②中用到的主要玻璃仪器有________________、玻璃棒和烧杯等。
(3)操作③主要包含蒸发浓缩、______________、过滤、洗涤烘干等。
(4)实验中可选用适量的下列试剂中的________________代替稀H2SO4(填标号)。
a.CuSO4溶液 b.FeSO4溶液 c.稀盐酸
相关试题

