【题目】(8分)某化学兴趣小组在室温的条件下(温度为20℃),为了测定H2SO4与NaOH发生中和反应时放出的热量,在左下图的小烧杯中加入8mL溶质质量分数为10%的NaOH溶液(密度1 g/mL),并滴入3滴酚酞,测量其温度;另取过量的稀硫酸(密度1.12g/mL),测量其温度后逐量缓慢地加入到小烧杯中,边加边用环形玻璃棒搅拌;测得烧杯中溶液温度的变化与加入稀硫酸体积之间关系如右下图所示。

(1)当加入5 mL稀硫酸时,溶液中的溶质有 (填写溶质化学式)。
(2)当加入约为 mL稀硫酸时,烧杯中溶液的温度达到最高。此时烧杯中溶液的温度约为(填写整数) ℃,烧杯中溶液颜色 。
(3)当加入稀硫酸的体积大于10mL时,溶液温度下降的原因是 。
(4)当溶液温度升到最高时,此时溶液中溶质质量分数是多少?(写出计算过程,共3分)
参考答案:
【答案】(1)Na2SO4、NaOH (2)10mL 38或39 无色
(3)过量的稀硫酸起冷却作用或散热 (4)7.4﹪
【解析】
试题分析:(1)H2SO4与NaOH发生中和反应时放出的热量,根据右上图可知,当加入10 mL稀硫酸时,溶液的温度最高,表示两者恰好完全反应,故当加入5 mL稀硫酸时,NaOH过量,故此时溶液中的溶质既有生成Na2SO4,还有过量的NaOH
(2)据图,当加入约为10mL稀硫酸时,烧杯中溶液的温度达到最高,由于原温度为20℃,反应放热使温度升高大约18~19℃,故此时烧杯中溶液的温度约为38或39,由于此时两者恰好完全反应,溶液显中性,故烧杯中溶液颜色为无色
(3)当加入稀硫酸的体积大于10mL时,溶液温度下降的原因是:过量的稀硫酸起冷却作用或散热
(4)根据化学方程式:2NaOH+H2SO4==Na2SO4+2H2O 中NaOH与Na2SO4的质量关系,可算出溶质Na2SO4的质量
解:设溶质Na2SO4的质量为x
2NaOH+H2SO4==Na2SO4+2H2O
142
8mL×1g/mL×10% x
80:142=8mL×1g/mL×10%:x
x=1.42g
溶液的质量=8mL×1g/mL+10mL×1.12g/mL=19.2g
溶液中溶质质量分数=1.42g/19.2g×100%=7.4%
答:溶液中溶质质量分数为7.4%
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质X是一种可再生绿色能源,其燃烧的化学方程式为X+3O2 点燃 2CO2+3H2O,则X的化学式为
A.C2H4 B.CH3OH C.C2H5OH D.C2H6
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语中,既能表示一种元素,又能表示一个原子,还能表示一种物质的是
A.N2 B.O C.Cu D.CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】(4分)小明为了验证CO的化学性质,他设计了如图所示的实验装置,请你结合装置图回答下列问题:
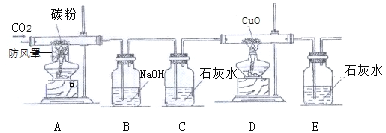
(1)写出下列装置中发生的化学反应方程式
装置A ,
装置D ,
(2)装置B的作用是 ;
(3)装置有一个明显不足,请指出具体的改进措施
-
科目: 来源: 题型:
查看答案和解析>>【题目】(7分)根据下列装置图回答下列问题.
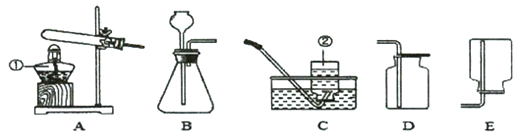
(1)请写出所标仪器的名称:①_________;
(2)实验室用B制取氢气时,反应的方程式为______;实验室收集氧气和二氧化碳都可用到的此装置是______(填序号,下同)
(3)用澄清石灰水检验二氧化碳,其反应的化学方程式为___ ;
(4)用装置A制氧气,装置A中的试管口略向下倾斜的目的是___ _;
(5)实验室用电石(固体)与水常温下反应制取乙炔(C2H2)。常温下,乙炔是一种无色气体,密度比空气略小,难溶于水。制取并收集乙炔的装置是 (填装置序号),若改用右图装置来收集乙炔,则气体应从 ____端进入。
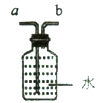
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于催化剂的说法正确的是
A.二氧化锰是催化剂
B.过氧化氢的分解不一定必须用到二氧化锰做催化剂
C.催化剂的质量和性质在化学反应前后不变
D.催化剂一定能加快物质的反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】(本题共5分)用化学符号和数字填空。
(1)天然最硬的物质是 ; (2)保持水的化学性质的最小粒子 ;
(3)两个铜原子 ; (4)标出氧化亚铁中铁元素的化合价 ;
(5)空气中体积含量最大的气体 。
相关试题

