【题目】如图是实验室制取气体的常用装置.

(1)写出标号仪器的名称:a .
(2)用高锰酸钾制氧气时,选择的发生装置是 .用C装置收集氧气,若收集到的氧气不纯,可能原因是 (写一点即可).该反应的化学方程式为 .用图F装置可以收集氧气:若F充满水来收集氧气,气体应从 (填“b”或“c”)端通入;
(3)从上述所给仪器中选择适当的仪器组成一套用过氧化氢制取并用排空气法收集氧气的装置,各仪器从左到右的连接顺序是 → .此套实验装置比用高锰酸钾制氧气的装置有一个明显的优点,是: .
(4)二氧化碳是一种无色、无味、密度比空气大,且可溶于水的气体;实验室常用块状的大理石(CaCO3)与稀盐酸(HCl)气体溶于水在常温下反应制取二氧化碳,同时生成CaCl2和H2O.你认为制取二氧化碳应选择的发生装置是 ;收集装置是 .请写出制取二氧化碳的化学方程式 .
参考答案:
【答案】(1)锥形瓶;
(2)B;未等气泡连续、均匀冒出就开始收集(合理均可);2KMnO4![]() K2MnO4+MnO2+O2↑;c;
K2MnO4+MnO2+O2↑;c;
(3)A→D;不需要加热,操作简单、安全;
(4)A;D;CaCO3+2HCl═CaCl2+H2O+CO2↑.
【解析】
试题分析:(1)据常用仪器回答;
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气,该反应属于固体加热型,故选发生装置B,并结合排水法收集氧气的注意事项和氧气密度比水小分析解答;
(3)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,该反应属于固液常温型,故选发生装置A,氧气密度比空气大,所以用向上排空气法收集;过氧化氢制取氧气与高锰酸钾制取氧气相比,明显的优点是不需加热、操作解答、安全;
(4)块状的大理石(CaCO3)与稀盐酸(HCl)气体溶于水在常温下反应制取二氧化碳属于固液常温型,故选发生装置A,二氧化碳密度比空气大且能溶于水,所以用向上排空气法收集,据反应 原理书写方程式.
解:(1)标号仪器是作为反应容器的锥形瓶;
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑,该反应属于固体加热型,故选发生装置B,用C装置收集氧气,若收集到的氧气不纯,可能是刚产生气泡就收集,或开始集气瓶中未装满水留有气泡,混入了空气;
K2MnO4+MnO2+O2↑,该反应属于固体加热型,故选发生装置B,用C装置收集氧气,若收集到的氧气不纯,可能是刚产生气泡就收集,或开始集气瓶中未装满水留有气泡,混入了空气;
氧气密度比水小,所以若F充满水来收集氧气,应从短管进气、长管便于排水;
(3)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,该反应属于固液常温型,故选发生装置A,氧气密度比空气大,所以用向上排空气法收集;过氧化氢制取氧气与高锰酸钾制取氧气相比,明显的优点是不需加热、操作解答、安全;
(4)块状的大理石(CaCO3)与稀盐酸(HCl)气体溶于水在常温下反应制取二氧化碳属于固液常温型,故选发生装置A,二氧化碳密度比空气大且能溶于水,所以用向上排空气法收集,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
故答案为:(1)锥形瓶;
(2)B;未等气泡连续、均匀冒出就开始收集(合理均可);2KMnO4![]() K2MnO4+MnO2+O2↑;c;
K2MnO4+MnO2+O2↑;c;
(3)A→D;不需要加热,操作简单、安全;
(4)A;D;CaCO3+2HCl═CaCl2+H2O+CO2↑.
-
科目: 来源: 题型:
查看答案和解析>>【题目】海水晒盐过程中,析出粗盐后剩余的溶液成为“苦卤”,关于苦卤的下列说法不正确的是( )
A.苦卤是氯化钠的饱和溶液 B.苦卤中氯化钠的质量分数比海水中的大
C.苦卤通电可以制的金属镁 D.苦卤也是一种重要的化工原料
-
科目: 来源: 题型:
查看答案和解析>>【题目】向澄清石灰水中滴加稀盐酸,在滴加过程中,对溶液描述不正确的是( )
A.Ca2+数目基本不变 B.OH-数目减少 C.Cl-数目增多 D.溶液的pH逐渐增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中错误的是
A.凡有盐和水生成的反应就是中和反应
B.可以利用中和反应原理来改良土壤
C.酸跟碱作用生成盐和水的反应一定是中和反应
D.中和反应属于复分解反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】用相应的数字和化学符号填空.
(1)两个铝离子 ;
(2)氩气 ;
(3)三个硫酸根离子
(4)5个水分子
(5)氧化亚铁中铁元素的化合价为正二价
(6)四个磷原子 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图所示实验装置回答有关问题.
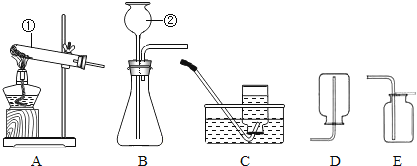
(1)写出标有序号的仪器名称:① ;② .
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式 .
(3)实验室制取二氧化碳气体,其反应的化学方程式为 ,应选择的发生装置为 (填写装置的字母代码,下同),收集装置为 ,检验二氧化碳是否收集满的方法是 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在化学课上提出:可用澄清石灰水来检验人呼出的气体中是否含有二氧化碳。就这一过程而言,属于科学探究环节中的
A.建立假设 B.收集证据
C.设计实验 D.做出结论
相关试题

