【题目】根据下图回答问题:

(1)装置图中标号仪器的名称:① ,② 。
(2)实验室若用A装置制取氧气,反应的化学方程式是 。
(3)实验室制取二氧化碳的化学方程式是 。
若用G收集二氧化碳,二氧化碳应从 (选“a”或“b”)进,装置C与装置B相比,其主要优点是 。
(4)工业上用碳酸钙在高温下分解来制取氧化钙和二氧化碳。
①若要制取5.6t氧化钙,需碳酸钙的质量是多少?(请写出计算过程)
②小华为测定某石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,数据如下表:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入5g | 1.0g |
第三次加入5g | 0.5g |
第四次加入5g | 0.4g |
这种石灰石样品中碳酸钙的质量分数为 。
若要制取5.6t氧化钙,理论上需要这种石灰石的质量是 。
参考答案:
【答案】(1)试管 集气瓶(2)2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(3)CaCO3+2HCl==CaCl2+H2O+CO2↑ a 可以控制反应的发生或停止
(4)①解:设需碳酸钙的质量为x。
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 56
x 5.6t
100︰56=x︰5.6t x=10t
答:需碳酸钙的质量为10t。
②80% ,12.5t
【解析】
试题分析:(2)装置A属固固加热型,试管口没有塞一团棉花,故是用加热氯酸钾的方法制取氧气,同时还生成氯化钾:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)实验室用石灰石和稀盐酸制取二氧化碳,同时还生成氯化钙和水:CaCO3+2HCl==CaCl2+H2O+CO2↑;二氧化碳的密度比空气大,会先聚集杂集气瓶的底部,故二氧化碳气体从a端通入;C装置中可将石灰石放在隔板上,稀盐酸从长颈漏斗加入,当不需要反应时,用止水夹夹住橡皮管,稀盐酸进入长颈漏斗中,固体和液体分离,反应停止,即该装置的优点是能控制反应的发生和停止;
(4)①利用化学方程式,根据反应的质量比即可计算出碳酸钙的质量;
解:设需碳酸钙的质量为x。
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 56
x 5.6t
100︰56=x︰5.6t
x =10t
答:需碳酸钙的质量为10t。
②根据表格信息加入5g稀盐酸能反应掉0.5g碳酸钙,可知碳酸钙样品的总质量为2g,最后还有0.4g固体剩余,即杂质的质量为0.4g,那么碳酸钙的质量=2g-0.4g=1.6g,
碳酸钙的质量分数=1.6g/2g ×100%=80%,
要制取5.6t氧化钙,理论上需要这种石灰石的质量=10t÷80%=12.5t
-
科目: 来源: 题型:
查看答案和解析>>【题目】为除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,可将粗盐溶解于水,然后进行下列五项操作:①过滤 ②加适量盐酸 ③加过量Na2CO3溶液 ④加过量NaOH溶液 ⑤加过量BaCl2溶液 ⑥蒸发, 正确的操作顺序是( )
A.①④⑤③②⑥
B.④①③⑤②⑥
C.⑤④③①②⑥
D.③④⑤①②⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关水的知识中,正确的说法是( )
A.水是一种最常见的溶剂,水不能称作为自然资源。空气才是自然资源。
B.常用的硬水软化的方法,蒸馏和煮沸都是物理变化。
C.电解水时生成的氢气和氧气的质量比为2 : 1
D.水是由氧元素和氢元素组成的。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各符号中数字“2”表示的意义不正确的是( )
A.2NO3—:两个硝酸根离子 B.N2:一个氮分子由两个氮原子构成
C.2Hg:两个汞原子 D.Fe2+:一个铁离子带两个单位的正电荷
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关水的说法正确的是
A.电解水生成氢气和氧气的质量比是2:1
B.将肥皂水加入硬水中搅拌会产生浮渣
C.CO、CO2都可以和水反应产生H2CO3
D.活性炭可以吸附水中的钙、镁离子和色素
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图,A、B、C、D、E、F均是初中化学的常见物质,A、B、C均含有同一种元素。变化①的现象是颜色由黑变红,变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出。回答下列问题:
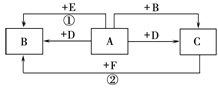
(1)D的化学式为 ;
(2)在变化①和②中,A和C的性质是相似的,都具有 ;
(3)写出变化①的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化是化学变化的是( )
A.蜡烛燃烧 B.雪糕融化 C.汽油挥发 D.玻璃破碎
相关试题

