【题目】现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生H2的质量为m,下列说法不正确的是( )
A.若混合物为Fe、Zn,m小于0.2g
B.若混合物为Fe、Al,m大于0.2g
C.若混合物为Fe、Zn,m可能是0.1g,则该混合物中铁的质量分数为50%
D.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%
【答案】C
【解析】
假设合金中铁的质量为5.6 g,稀盐酸的溶质质量分数为x,则
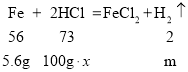
![]() ,
,![]()
m=0.2g,x=7.3%;
假设合金中锌的质量为5.6 g,则
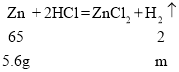
![]()
m=0.175g<0.2g;
假设合金中铝的质量为5.6 g,稀盐酸的溶质质量分数为y,则
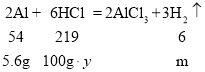
![]() ,
,![]()
m=0.62g>0.2 g,y=22.7%。
A、若混合物为Fe、Zn,m一定小于0.2g,说法正确;
B、若混合物为Fe、Al,m一定大于0.2g,说法正确;
C、若混合物为Fe、Zn,则0.175g <m<0.2g,m不可能是0.1g,说法错误;
D、当粉末为Fe、Al合金时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6 g全部是铁时,盐酸的溶质质量分数为7.3%,5.6 g全部是铝时,盐酸的溶质质量分数为22.7%,所以合金为为Fe-Al合金时,所需盐酸溶质质量分数一定大于7.3%,说法正确。
故选:C。

