【题目】生活中处处有化学。
(1)体温计中的液体金属化学式为___________。
(2)玻璃的主要成分是SiO2,SiO2读作___________。
(3)生石灰常用作食品干燥剂,其干燥原理是___________(用化学方程式表示)。
(4)医用消毒酒精中酒精的化学式为C2H5OH,碳、氢元素原子个数比为___________。0.1mol酒精的质量为___________g ,含有___________个氢原子。
参考答案:
【答案】 Hg 二氧化硅 CaO+H2O→Ca(OH)2 2:6或1:3 4.6 3.612×1023
【解析】(1)体温计中的液体金属是汞,化学式为Hg。
(2)玻璃的主要成分是SiO2,SiO2读作二氧化硅。
(3)生石灰常用作食品干燥剂,其干燥原理是生石灰与水反应生成氢氧化钙,反应方程式为CaO+H2O=Ca(OH)2。
(4) C2H5OH中碳、氢元素原子个数比为2:6=1:3;0.1mol酒精的质量为0.1mol![]() 46g/mol=4.6g;0.1mol酒精中含有的氢原子的个数为0.1mol
46g/mol=4.6g;0.1mol酒精中含有的氢原子的个数为0.1mol![]() 6.02
6.02![]() 1023=3.612×1023;
1023=3.612×1023;
-
科目: 来源: 题型:
查看答案和解析>>【题目】传统干电池在日常生活中有多方面的应用,如图显示的是干电池的内部构造,请回答:列问题:
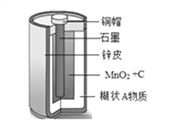
(1)写出干电池正极材料主要成分的化学式:________;上述材料中属于金属材料的是_________(写一种);
(2)取干电池内的填充物溶于水,过滤,洗涤、干燥滤渣成分是MnO2和C,为了得到比较纯净的MnO2,可采用的简单方法是_____________,写出反应方程式_______________;
(3)石墨用作电极是利用了其导电性,请写出一条其他的用途:_______________________;
(4)请用一个化学方程式表示锌比铜活泼:__________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下稀盐酸和氢氧化钙发生的中和反应实验探究。
【演示实验】由图可知该实验操作是将______________滴加到另一种溶液中。该反应的化学方程式是___________________________;
【查阅资料】CaCl2溶液显中性, CaCl2+Na2CO3 =CaCO3↓+2NaCl
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2
猜想Ⅱ:有____________________
猜想Ⅲ:有CaC12和Ca(OH)2
猜想Ⅳ:有CaCl2、HC1和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是____________________________;
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案
滴加紫色石蕊试液
通入CO2
滴加Na2CO3溶液
实验操作

实验现象
_______________
______________
产生白色沉淀
实验结论
溶液中含有Ca(OH)2
溶液中含有Ca(OH)2
溶液中含有Ca(OH)2
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_______________________________;
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑________________。
-
科目: 来源: 题型:
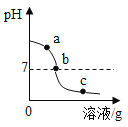
查看答案和解析>>【题目】向一定质量FeCl2和CuCl2的混合溶液中加入锌粉,反应过程中,混合物中溶液的质量与加入锌的质量关系如图所示,该反应过程中混合物中的溶液和固体的有关说法正确的是
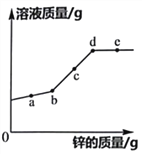
A. a点时,溶液中只含有两种溶质
B. c点时,向固体中滴加稀盐酸,无气泡产生
C. d点时,溶液中的溶质为ZnCl2
D. e点时,固体中只含两种物质
-
科目: 来源: 题型:
查看答案和解析>>【题目】图1装置左管带孔的燃烧匙内盛有足量的锌粒,右管盛有稀硫酸。
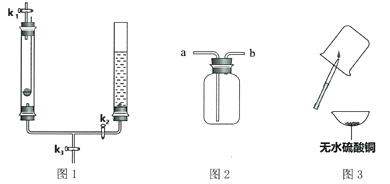
(1)关闭K3,打开K1和K2,除了右管液面下降,还会出现的现象是_______________________。
写出产生该现象的化学方程式_______________________。
(2)在K1的导管口处用橡皮管连接图2的_________________(填“a”或“b”)端收集气体。
(3)按图3进行实验,用橡皮管与K1相连接并点燃尖嘴管,可观察到的现象是________________;
(4)为了使反应停止,正确的操作是____________________,该装置的优点是____________________。
(5)用下列部分仪器,组装一套与上面装置有相同优点的装置,用编号表示组装的装置__________。
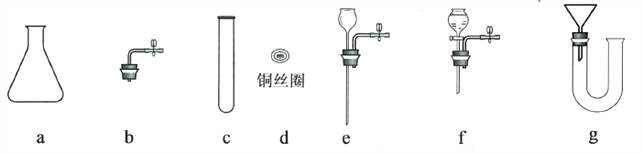
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验一:电子天平AB的表面皿中分别盛有浓HCl、浓H2SO4,放置一段时间。
(1)A中的示数变小,原因是____________________________________。
(2)与图C所示变化相一致的是_______________(选填“A”或“B”)
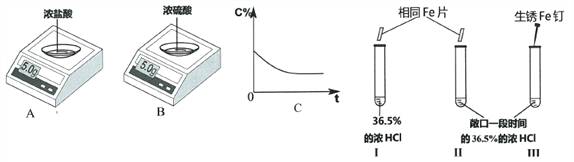
实验二:做对比实验,得出相应结论。
(3)I和II试管中都产生气泡,且I中比II中剧烈。此现象说明物质反应的快慢与_______________有关。
III试管中可能的现象是____________________________________。
请用化学方程式解释其原因_________________、___________________。
(4)如图所示,比较金属的活动性大小。实验现象:试管IV比试管V中产生气泡剧烈。得出结论:金属活动性X>Y。我不赞同此结论,理由是____________________________________。完成本实验需要控制的变量是____________________________________。
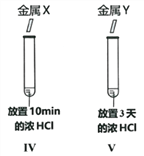
-
科目: 来源: 题型:
查看答案和解析>>【题目】溶液在生产、生活中起着十分重要的作用。
(1)可作为溶质的是_______。
A.只有固体 B. 只有液体
C.只有气体 D. 气体、液体、固体都可以
(2)物质加入足量水中,能形成无色透明溶液的是_______。
A.汽油 B. 面粉 C. 纯碱 D. 硫酸铜
(3)物质加入水中形成溶液过程中,温度会升高的是_______。
A.烧碱 B. 氯化钠 D. 氧化钙 D. 碳酸钙
(4)下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃
10
20
30
40
50
60
溶解度g/100g水
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
20.9
31.6
45.8
63.9
85.5
110.0
①两种物质中,溶解度受温度影响变化较大的是__________。
②NaCl和KNO3溶解度相等的温度范围是__________。
③KNO3晶体中含有少量NaCl,提纯KNO3晶体的方法是__________。
④60℃时,按图示操作:
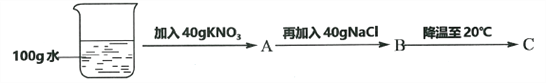
A中溶液是__________(填“饱和”或“不饱和”)溶液,C中溶液的总质量是__________g。
⑤50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液__________(填“大于”“等于”或“小于”)KNO3溶液。
相关试题

