【题目】Na2CO3中往往会含有少量的NaCl,现在一烧杯中盛有20.4g的固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
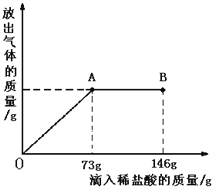
(1)当滴加稀盐酸至图中B点时,烧杯中溶的pH 7(填>、=、<)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
参考答案:
【答案】① < ②24.2%
【解析】试题分析:①根据图示,当滴加稀盐酸至图中A点时,表示所加的稀盐酸与Na2CO3恰好反应,而当滴加稀盐酸至图中B点时,表示盐酸过量,故此时烧杯中溶液的pH<7
②当滴加稀盐酸至图中A点时,表示所加的稀盐酸与Na2CO3恰好反应,根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中HCl与Na2CO3、NaCl的质量关系,可分别求出Na2CO3、NaCl的质量,进一步计算溶质的质量分数
解:设生成NaCl的质量为x,Na2CO3的质量为y,二氧化碳质量为z
Na2CO3 + 2HCl ="=" 2NaCl+H2O+CO2↑
106 73 117 44
y 73g×10% x z
73:117=73g×10%:x x=11.7g
73:106=73g×10%:y y=10.6g
73:44=73g×10%:z z=4.4g
故溶液中的溶质质量=(20.4-10.6g)+11.7g=21.5g
溶液的质量=20.4g+73g—4.4g=89g
所以溶质的质量分数=21.5g/89g×100%=24.2%
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是氧化沉淀法生产复印用高档Fe3O4粉的部分工艺流程简图。
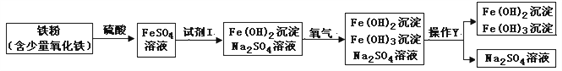
(1)试剂I和操作Y的名称分别为________________、___________________。
(2)硫酸与氧化铁的反应为__________________________________。
(3)往铁粉(含少量氧化铁)中加入硫酸,除铁、氧化铁与硫酸发生反应外,一定还发生其它反应。作出这种判断的依据是________________________________。
(4)某铁矿主要成分为Fe3O4,利用CO将该物质中铁还原出来的方程式为__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年湖北省襄阳市】AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3见光分解时产生一种有刺激性气味的气体,该气体可能是( )
A.SO2 B.NH3 C.N2 D.NO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年湖南省邵阳市】某化学反应可表示为:二氧化碳+水→M+氧气,根据以上信息,下列关于M组成的说法中正确的是( )
A.一定含有C、H元素,可能含有O元素 B.只含有C、B元素
C.含有C、H、O三种元素 D.无法确定
-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年1月9日,国务院将国家最高科学技术奖授予赵忠贤院士与屠呦呦研究员两位科学家。我国科学家屠呦呦因发现用于治疗疟疾的药物——青蒿素 (化学式为C15H2205),因而获得2015年诺贝尔生理学及医学奖。下列关于青蒿素的叙述错误的是( )

A. 青蒿素属于有机物
B. 青蒿素的相对分子质量为282g
C. 青蒿素的一个分子中含有45个原子
D. 青蒿素中碳元素的质量分数约为63.8%
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化钛(化学式为TiO2)俗称钛白,是世界上最白的物质,常用作高级白色颜料。二氧化钛中钛元素的化合价是
A.2 B.+2 C.+3 D.+4
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年湖南省邵阳市】在2A+B═2C反应中,已知A的相对分子质量是28,C的相对分子质量是44,则B的相对分子质量是( )
A.16g B.16 C.32g D.32
相关试题

