【题目】素有“铜都”之称的安徽铜陵有许多黄铜矿(主要成分为CuFeS2)。黄铜矿经初步 处理后,所得溶液甲中的溶质为 Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反 应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图所示:
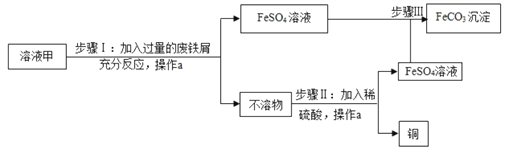
(1)Fe2(SO4)3与铁反应的化学方程式如下,请配平:xFe2(SO4)3+yFe=zFeSO4,其中x、y、z为化学计量数,z的值为_____;
(2)步骤Ⅰ中,生成铜的化学方程式:_________。废铁屑含有少量铁锈,对产物的成分没有影响,原因是_____;
(3)操作a名称为_____,为提高操作a的速率,可以采取的方法有_____;
(4)不溶物的成分为_____ (填化学式)。
参考答案:
【答案】 3 Fe+CuSO4=Cu+FeSO4 氧化铁和硫酸反应生成的硫酸铁再和铁反应生成 硫酸亚铁 过滤 先静置,再过滤 Cu、Fe(全对得分)
【解析】本题考查了金属的性质,过滤,化学方程式的配平等。首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答。
(1)将方程式xFe2(SO4)3+yFe=zFeSO4配平得:Fe2(SO4)3+2Fe=3FeSO4,z的值为3;
(2)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是氧化铁和硫酸反应生成的硫酸铁,再和铁反应生成硫酸亚铁;
(3)由流程图可知,操作a是将固体与液体分离,名称是过滤,为提高操作a的速率,可以采取的方法有先静置,再过滤;
(4)所得“不溶物”中含两种金属,其成分是剩余的铁和置换出的铜化学式是Fe、Cu。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示),下列说法正确的是( )
氢氧化钠
碳酸钠
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
不溶
不溶

A. 上述图象表示碳酸钠的溶解度曲线
B. 20℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将 50g NaOH 分别投入到 100g 水和 100g 酒精中,都能形成饱和溶液
D. 40℃时,将适量 CO2 通入饱和的 NaOH 酒精溶液中,观察不到明显的现象
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有下列仪器或装置,请回答下列问题:
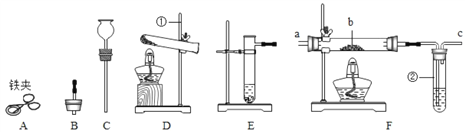
(1)仪器(1)的名称是_____。用废铁屑与稀硫酸反应制取H2,应选择上图仪器中的_____(填字母),该反应的化学方程式为_____;
(2)若用F装置在通风橱内进行CO还原CuO的实验,实验时操作顺序为_____(填序号);
A.先通CO后加热 B.先加热后通CO
(3)用橡皮管、注射器和水,检验 F 装置气密性的操作和现象是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国自行研发的大型客机C919成功试飞,请根据所学知识回答问题。
(1)选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金的硬度和强度______填“大 于”或“小于”)纯铝;
(2)飞机所用的下列材料属于合成材料的是_____(填序号);
A.塑料扶手 B.纯羊毛毯 C.真皮座套 D.铜制扣件
(3)飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与_____接触;
(4)金属铍(Be)与铝化学性质相似,铍元素的核电荷数为4,相对原子质量为9。
①铍原子结构示意图为_____(填序号);
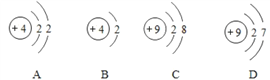
②在空气中,铍的表面易形成一层氧化铍的保护膜,发生反应的化学方程式为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(题文)生石灰是一种传统的建筑材料,俗称“石灰”。 安徽凤阳大量石灰厂在石灰窑中 煅烧石灰石制得“石灰”,其反应原理是__________(用化学方程式表示)。化学兴趣小组的 同学对某石灰厂刚出窑的“石灰”的成分进行探究。
(提出问题)刚出窑的“石灰”有哪些成分?
(猜想) I.只有氧化钙 Ⅱ.只有碳酸钙
Ⅲ.____________________________;
(查阅资料)碱和碳酸盐同时存在时,酸碱中和反应优先于酸与碳酸盐的反应。
(实验探究)
(1)甲同学取一定量的“石灰”样品于试管中,并加入一定量的水,振荡,有白色不溶物。 甲同学据此认为试管中的固体为碳酸钙,即猜想 II 成立。乙同学认为上述实验不足以证明 猜想 II 成立,其理由是_________________________________;
(2)乙同学取一定量的“石灰”样品于试管中,加入一定量的水,触摸试管外壁,感觉发热; 继续向试管中加入几滴稀盐酸,没有发现气泡产生。乙同学据此认为试管中的固体只有氧化 钙 , 即 猜 想 I 成 立 。 丙 同 学 认 为 乙 同 学 的 实 验 不 足 以 证 明 猜 想 I 成 立 , 理 由 是_____;
(3)使用“石灰”的建筑工地上常有一个大的石灰池,使用“石灰”时,先将生石灰倒入池内 水中,一段时间后,再取用其中的石灰浆使用。长期使用的石灰池内壁会逐渐增厚,其主要 原因是_________________(用化学方程式表示);
(4)丙同学用水、酚酞试液和稀盐酸证明了猜想Ⅲ成立,丁同学将酚酞试液换成盐溶液也 能完成实验,请完成实验报告。
实验方案
实验步骤
实验现象
实验结论
丙同学
________
__________
猜想Ⅲ成立
丁同学
_______
____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】(题文)如图是某种胃药的部分标识,胃药中所含的物质能中和胃里过多的胃酸(主要 是盐酸)。某患者按标识上的服用方法服药,服药三天后病情好转。计算患者在三天内所服的此胃药中:

(1)所含 Al(OH)3 的质量_____;
(2)理论上可中和胃酸中 HCl 的质量为多少_______?
-
科目: 来源: 题型:
查看答案和解析>>【题目】密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是

物质
甲
乙
丙
丁
反应前质量(克)
50
11
15
32
反应后质量(克)
64
M
5
28
A. 该反应是化合反应
B. M的值是15
C. 乙一定是催化剂
D. 反应中甲、丁质量比为16 :7
相关试题

